Hvordan adskiller et fast stof sig fra flydende fase på molekylært niveau?
Molekylær arrangement:
1. Faststoffer :I faste stoffer er molekyler eller partikler tæt pakket sammen i et regulært og gentaget arrangement. Partiklerne holdes ofte i faste positioner af stærke intermolekylære kræfter, der danner en stiv struktur. Dette arrangement giver faste stoffer en bestemt form og volumen.
2. Væsker :I væsker er molekyler også tæt pakket, men de har mere bevægelsesfrihed sammenlignet med faste stoffer. Partiklerne sidder ikke fast og kan relativt let bevæge sig forbi hinanden. Dette tillader væsker at flyde og tage form af deres beholder.
Intermolekylære kræfter:
1. Faststoffer :Faste stoffer har stærke intermolekylære kræfter, såsom kovalente bindinger, ionbindinger eller hydrogenbindinger. Disse kræfter holder partiklerne tæt sammen, forhindrer betydelig bevægelse og opretholder den faste struktur.
2. Væsker :Væsker har svagere intermolekylære kræfter sammenlignet med faste stoffer. Disse kræfter inkluderer Van der Waals-kræfter (herunder dipol-dipol-kræfter og London-dispersionskræfter), som er svagere end kovalente eller ioniske bindinger. De svagere kræfter giver mulighed for større molekylær mobilitet i væsker.
Diffusion og viskositet:
1. Faststoffer :Diffusion er bevægelsen af partikler fra et område med højere koncentration til et område med lavere koncentration. I faste stoffer er diffusionen meget langsom på grund af de stærke intermolekylære kræfter og faste positioner af partiklerne.
2. Væsker :Væsker har en højere diffusionshastighed sammenlignet med faste stoffer. De svagere intermolekylære kræfter og øget molekylær mobilitet tillader partikler at bevæge sig mere frit, hvilket letter hurtigere diffusion.
Viskositet refererer til en væskes modstand mod strømning. Faste stoffer har en høj viskositet på grund af de stærke intermolekylære kræfter, mens væsker har en lavere viskositet på grund af svagere intermolekylære kræfter.
Sammenfattende adskiller faste stoffer sig fra væsker på molekylært niveau med hensyn til deres molekylære arrangement og intermolekylære kræfter. Faste stoffer har en stiv struktur med stærke intermolekylære kræfter, mens væsker har svagere intermolekylære kræfter og mere molekylær mobilitet. Disse forskelle resulterer i de forskellige egenskaber, vi observerer i faste og flydende tilstande af stof.
Sidste artikelHvor mange elektroner har O?
Næste artikelFordamper kun, eller fordamper andre væsker også?
 Varme artikler
Varme artikler
-
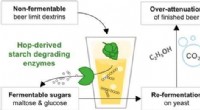 Humlet øl uden eksploderende flasker og for meget alkoholKredit:American Chemical Society Den glemte kunst at tør-hoppe øl for at forbedre smagen er tilbage på mode. Men denne praksis har undertiden uønskede bivirkninger, såsom et uventet højt alkoholin
Humlet øl uden eksploderende flasker og for meget alkoholKredit:American Chemical Society Den glemte kunst at tør-hoppe øl for at forbedre smagen er tilbage på mode. Men denne praksis har undertiden uønskede bivirkninger, såsom et uventet højt alkoholin -
 Bakterier gør blå jeans grønneBio-indican kan bruges som en effektiv, reduktionsmiddelfri bomuldstekstilfarve. (a) Øverste række, Ren indican uden β-glucosidase (BGL); ren indican med β-glucosidase; bio-indican med β-glucosidase.
Bakterier gør blå jeans grønneBio-indican kan bruges som en effektiv, reduktionsmiddelfri bomuldstekstilfarve. (a) Øverste række, Ren indican uden β-glucosidase (BGL); ren indican med β-glucosidase; bio-indican med β-glucosidase. -
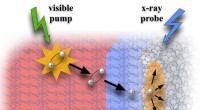 Langsom ladningsgenerering spiller en stor rolle i modelmateriale til solcellerSynlig pumpe / røntgensonde fotoelektronspektroskopi overvåger exciton-migrering og ladningsgenerering i en molekylær heterojunction mellem en kobber-phthalocyanin (CuPc) donor og en fulleren-baseret
Langsom ladningsgenerering spiller en stor rolle i modelmateriale til solcellerSynlig pumpe / røntgensonde fotoelektronspektroskopi overvåger exciton-migrering og ladningsgenerering i en molekylær heterojunction mellem en kobber-phthalocyanin (CuPc) donor og en fulleren-baseret -
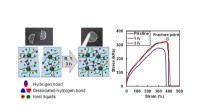 Fremtiden for elektroniske enheder:Stærke og selvhelbredende iongelerIongelen udviser hurtig selvhelbredende evne ved stuetemperatur ved at omdanne hydrogenbindinger på den beskadigede overflade. Brudspændingen af iongelen efter heling 3 timer er sammenlignelig med d
Fremtiden for elektroniske enheder:Stærke og selvhelbredende iongelerIongelen udviser hurtig selvhelbredende evne ved stuetemperatur ved at omdanne hydrogenbindinger på den beskadigede overflade. Brudspændingen af iongelen efter heling 3 timer er sammenlignelig med d
- ID -tyveri stikker, men det er svært at fastgøre bestemte datahacks
- Klimaændringer har reduceret havblanding langt mere end forventet
- Syntetiseres polypeptidhormoner fra tyrosin og tryptofan?
- Er det tid til at droppe årlige præstationsvurderinger?
- Fastfrosset i tiden:Gamle malerier og nye fotografier afslører, at nogle NZ-gletsjere snart kan væ…
- Tidsrejsende er velkomne til Hawkings mindehøjtidelighed


