Hvordan ændres volumenet af en ideel gas ved konstant temperatur og tryk, når antallet af molekyler stiger?
$$P_1V_1 =P_2V_2 $$
Hvor:
- $$P_1$$ og $$V_1$$ er det indledende tryk og volumen af gassen.
- $$P_2$$ og $$V_2$$ er det endelige tryk og volumen af gassen.
Hvis vi betragter situationen, hvor trykket forbliver konstant, $$P_1 =P_2$$, så kan ligningen omarrangeres for at vise forholdet mellem volumen og antallet af molekyler:
$$V_1/n_1 =V_2/n_2$$
Hvor:
- $$n_1$$ og $$n_2$$ er det indledende og endelige antal molekyler i gassen.
Denne ligning indikerer, at volumenet af en ideel gas ved konstant tryk og temperatur er direkte proportional med antallet af molekyler.
- I simplere termer, når antallet af molekyler i en ideel gas stiger, vil dens volumen også stige, mens både trykket og temperaturen forbliver konstant.
 Varme artikler
Varme artikler
-
 Super-adsorberende MOF fanger dobbelt så meget i vandDenne figur viser strukturen Hydrolytisk stabil og meget porøs Cr-soc-MOF-1, som kan fange dobbelt sin vægt i adsorberet vand. Kredit:Prof.Mohamed Eddaoudi (KAUST) Materialekemikere i Kongeriget S
Super-adsorberende MOF fanger dobbelt så meget i vandDenne figur viser strukturen Hydrolytisk stabil og meget porøs Cr-soc-MOF-1, som kan fange dobbelt sin vægt i adsorberet vand. Kredit:Prof.Mohamed Eddaoudi (KAUST) Materialekemikere i Kongeriget S -
 E-affaldsspisende protein skaber sjældne jordarterDenne illustration viser lanmodulin, et lille protein, som er et bio-source alternativ til ekstrakt, rense og genbruge sjældne jordarters grundstoffer fra forskellige kilder, herunder elektronisk affa
E-affaldsspisende protein skaber sjældne jordarterDenne illustration viser lanmodulin, et lille protein, som er et bio-source alternativ til ekstrakt, rense og genbruge sjældne jordarters grundstoffer fra forskellige kilder, herunder elektronisk affa -
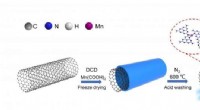 Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne
Mangan-enkeltatom-katalysator øger ydeevnen af elektrokemisk reduktion af kuldioxidSkematisk diagram af Mn SAC-fremstilling og mekanisme for elektrokemisk CO 2 reduktion. Kredit:FENG jiaqi Elektrokemisk CO 2 reduktionsreaktion (CO 2 RR) er en lovende tilgang til at omdanne -
 Ny modelleringstilgang hjælper laserglasdesignMålte og kurvetilpasning afledte IR-spektre af P, PL, PN glasprøver, og individuelle bånd af P-glas ifølge litteratur. Kredit:SIOM Nd-doterede fosfatglas bruges i laserapplikationer med høj energi
Ny modelleringstilgang hjælper laserglasdesignMålte og kurvetilpasning afledte IR-spektre af P, PL, PN glasprøver, og individuelle bånd af P-glas ifølge litteratur. Kredit:SIOM Nd-doterede fosfatglas bruges i laserapplikationer med høj energi
- Ny lysende kvasar opdaget af astronomer
- Variationer i vibrationer i siliciumbjælker skaber en følsom måde at måle trykændringer på
- Undersøgelse kan føre til produktion af mere effektive optoelektroniske enheder
- Hvordan partipolitisk kunne tage en bid af din pengepung
- Varmetransport kan blokeres mere effektivt med en mere optimeret hullet nanostruktur
- SpaceX genbrugelig raket misser landende skib


