Hvordan ville ligevægtskoncentrationen af H2O blive påvirket af at tilsætte en katalysator til blandingen?
En katalysator er et stof, der øger hastigheden af en kemisk reaktion uden at blive forbrugt i reaktionen. Katalysatorer virker ved at give en alternativ vej for reaktionen til at finde sted, som har en lavere aktiveringsenergi end den ukatalyserede reaktion. Det betyder, at flere reaktantmolekyler har nok energi til at nå overgangstilstanden og danne produkter, hvilket fører til en hurtigere reaktionshastighed.
Katalysatorer ændrer dog ikke ligevægtspositionen af en reaktion. Ligevægtspositionen bestemmes af de relative koncentrationer af reaktanter og produkter ved ligevægt og påvirkes ikke af tilstedeværelsen af en katalysator. Dette skyldes, at katalysatoren fremskynder både fremadgående og omvendte reaktioner ligeligt, så ligevægtskoncentrationerne af reaktanter og produkter ændres ikke.
Derfor vil tilsætning af en katalysator til en blanding øge hastigheden, hvormed H2O produceres, men det vil ikke påvirke ligevægtskoncentrationen af H2O.
 Varme artikler
Varme artikler
-
 Mekaniske egenskaber af viralt DNA bestemmer infektionsforløbetVira kan injicere deres DNA i en værtscelle synkront eller tilfældigt, finder en ny undersøgelse. Forskellen ser ud til at påvirke infektionsforløbet. Kredit:Alex Evilevitch og Ting Liu En ny unde
Mekaniske egenskaber af viralt DNA bestemmer infektionsforløbetVira kan injicere deres DNA i en værtscelle synkront eller tilfældigt, finder en ny undersøgelse. Forskellen ser ud til at påvirke infektionsforløbet. Kredit:Alex Evilevitch og Ting Liu En ny unde -
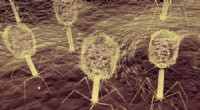 Viruss mangestrengede angreb på bakterier peger på nye måder at bekæmpe infektion påFager angriber en bakterie. Kredit:Imperial College London Forskere har afdækket, hvordan en virus anvender et todelt angreb mod et enkelt protein for at dræbe bakterier. Den internationale grupp
Viruss mangestrengede angreb på bakterier peger på nye måder at bekæmpe infektion påFager angriber en bakterie. Kredit:Imperial College London Forskere har afdækket, hvordan en virus anvender et todelt angreb mod et enkelt protein for at dræbe bakterier. Den internationale grupp -
 Påvisning af blodpletter - med en antimalarial forbindelseAt fortælle hvilken plet på disse papirfiltre (øverste række) er fra blod (C) frem for kaffe (A) eller te (B) er lettere med en ny forbindelse, der reagerer med blod og lyser i mørket (nederste række,
Påvisning af blodpletter - med en antimalarial forbindelseAt fortælle hvilken plet på disse papirfiltre (øverste række) er fra blod (C) frem for kaffe (A) eller te (B) er lettere med en ny forbindelse, der reagerer med blod og lyser i mørket (nederste række, -
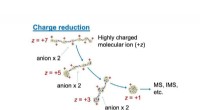 Et kæmpe fremskridt inden for spektrometriEn afbildning af ladningsreduktionsproces, der bruges som en forbehandlingsproces af massespektrometri, MS (eller ionmobilitetsspektrometri, IMS). For at øge nøjagtigheden af spektrum, overskydende
Et kæmpe fremskridt inden for spektrometriEn afbildning af ladningsreduktionsproces, der bruges som en forbehandlingsproces af massespektrometri, MS (eller ionmobilitetsspektrometri, IMS). For at øge nøjagtigheden af spektrum, overskydende
- For første gang, astronomer fanger asteroide i færd med at skifte farve
- Fældning af fyrretræer:Gør det før snarere end senere er bedre for fynbos
- Forskere undersøger strukturen i en nøgleregion af langtidsprotein -telomerase
- Undersøgelse viser, hvordan ru mikropartikler kan give store problemer
- Transit (i astronomi)
- Amazonas regnskovs økosystem


