Hvad sker der i en syrebaseret reaktion ifølge Arrhenius definition?
En syre er ifølge Arrhenius-definitionen et stof, der, når det opløses i vand, øger koncentrationen af hydrogenioner (H+) i opløsningen. En base er derimod et stof, der, når det opløses i vand, øger koncentrationen af hydroxidioner (OH-) i opløsningen.
Syre:HA (stof) + H2O → H3O+ (hydroniumion) + A- (konjugeret base)
Base:B (stof) + H2O → BH+ (konjugeret syre) + OH- (hydroxidion)
Syre-base-reaktion
Når en syre og en base reagerer, kombineres H+ ionerne fra syren med OH- ionerne fra basen og danner vandmolekyler (H2O). Denne proces kaldes neutralisering. Produkterne af en neutraliseringsreaktion er et salt (en forbindelse sammensat af positivt ladede ioner og negativt ladede ioner) og vand.
Arrhenius syre-basereaktion:Syre (H+ donor) + Base (OH-donor) → Salt + Vand (H2O)
Her er et generelt eksempel på en syre-base reaktion mellem saltsyre (HCl) og natriumhydroxid (NaOH):
- Reaktanter :HCl (syre) + NaOH (base)
- Produkter :NaCl (salt) + H2O (vand)
Reaktionen kan repræsenteres som følger:
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
I denne reaktion kombineres H+ ionerne fra HCl med OH- ionerne fra NaOH for at danne vandmolekyler (H2O). De resterende ioner (Na+ og Cl-) kombineres for at danne saltet natriumchlorid (NaCl).
 Varme artikler
Varme artikler
-
 Hele forestillingen, intet af balladen:nitrilhydrogenering udført rigtigtFigur 1:Katalytisk hydrogenering af nitriler til primære aminer. Kredit:Osaka University Behovet for at være opmærksomme forbrugere er ved at blive en prioritet for en stadigt voksende del af samf
Hele forestillingen, intet af balladen:nitrilhydrogenering udført rigtigtFigur 1:Katalytisk hydrogenering af nitriler til primære aminer. Kredit:Osaka University Behovet for at være opmærksomme forbrugere er ved at blive en prioritet for en stadigt voksende del af samf -
 Hvordan guld kan genbruge biobrændstofaffald til nyttigt additivProfessor Alexey Pestryakov. Kredit:Tomsk Polytechnic University (TPU) Guldnanopartikler tjener som katalysatorer til fremstilling af værdifulde kemiske produkter baseret på glycerol. Forskere fra
Hvordan guld kan genbruge biobrændstofaffald til nyttigt additivProfessor Alexey Pestryakov. Kredit:Tomsk Polytechnic University (TPU) Guldnanopartikler tjener som katalysatorer til fremstilling af værdifulde kemiske produkter baseret på glycerol. Forskere fra -
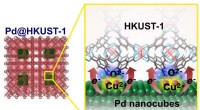 Grænseflade elektronisk tilstand, der forbedrer brintlagringskapacitet i Pd-MOF-materialer(Venstre) Struktur af en Pd@HKUST-1. (Højre) Skematisk diagram, der illustrerer overførslen af elektrisk ladning fra en Pd nanocube til HKUST-1 MOFer (metal-organiske rammer) Kredit:NIMS NIMS, K
Grænseflade elektronisk tilstand, der forbedrer brintlagringskapacitet i Pd-MOF-materialer(Venstre) Struktur af en Pd@HKUST-1. (Højre) Skematisk diagram, der illustrerer overførslen af elektrisk ladning fra en Pd nanocube til HKUST-1 MOFer (metal-organiske rammer) Kredit:NIMS NIMS, K -
 Blandet og matchet:Integrering af metal-organiske rammer i polymerer til kuldioxidadskillelsePolymermembraner til gasseparation kan blive afgørende teknologi til at forhindre overdreven udledning af CO2, bremser den globale opvarmning. Kredit:Chris LeBoutillier på Pexels En af menneskehed
Blandet og matchet:Integrering af metal-organiske rammer i polymerer til kuldioxidadskillelsePolymermembraner til gasseparation kan blive afgørende teknologi til at forhindre overdreven udledning af CO2, bremser den globale opvarmning. Kredit:Chris LeBoutillier på Pexels En af menneskehed
- Er mænd mere voldelige end kvinder?
- Sådan fungerer Gene Doping
- Vil Twitters giftpille være for hård for Elon Musk at sluge?
- Kan en samlet vej for udvikling og bevaring føre til en bedre fremtid?
- Årsager til ekstremt vejr og klimahændelser i Kina i løbet af 2020/21
- Hvor sker produktionen af iltgas i en celle?


