Hvordan påvirker temperaturen opløseligheden af det meste faststof?
1. Øget molekylær kinetisk energi: Ved højere temperaturer har molekylerne af både det faste opløste stof og det flydende opløsningsmiddel højere kinetisk energi. Denne øgede energi fører til kraftigere molekylær bevægelse og større kollisioner mellem de opløste partikler og opløsningsmiddelmolekylerne. Som et resultat dispergeres de opløste partikler lettere og opløses i opløsningsmidlet.
2. Forbedrede interaktioner mellem opløst stof og opløsningsmiddel: Højere temperaturer øger også interaktionerne mellem de opløste partikler og opløsningsmiddelmolekylerne. Den øgede kinetiske energi overvinder de intermolekylære kræfter, der holder de opløste partikler sammen, hvilket tillader dem at bryde væk fra det faste gitter og interagere med opløsningsmiddelmolekylerne. Dette fører til dannelsen af flere opløst stof-opløsningsmiddel-interaktioner og som følge heraf øget opløselighed.
3. Diffusion og masseoverførsel: Temperaturen påvirker diffusionshastigheden og masseoverførsel i opløsningen. Højere temperaturer accelererer bevægelsen af opløste partikler og opløsningsmiddelmolekyler, hvilket letter deres spredning gennem opløsningen. Denne øgede masseoverførsel forbedrer opløsningsprocessen, hvilket resulterer i højere opløselighed.
4. Damptryk og ligevægt: Opløseligheden af et fast stof i en væske påvirkes også af det faste stofs damptryk. Ved højere temperaturer stiger damptrykket af det faste stof. Denne stigning i damptryk begunstiger sublimeringen af det faste stof, som konkurrerer med opløsningsprocessen. Som et resultat heraf kan opløseligheden af det faste stof være begrænset af dets damptryk ved højere temperaturer.
Men i nogle tilfælde kan opløseligheden af faste stoffer falde med stigende temperatur. Dette observeres for visse forbindelser, der gennemgår specifikke faseovergange eller kemiske ændringer ved højere temperaturer. For eksempel falder opløseligheden af calciumsulfat (gips) med stigende temperatur over 42°C på grund af dannelsen af en mindre opløselig vandfri form.
Sammenfattende har temperatur generelt en positiv effekt på opløseligheden af de fleste faste stoffer i væsker. Den øgede molekylære kinetiske energi, forbedrede interaktioner mellem opløst stof og opløsningsmiddel, accelereret diffusion og masseoverførsel fremmer opløsningsprocessen og resulterer i højere opløselighed ved højere temperaturer. Der findes dog undtagelser for specifikke forbindelser, der udviser unik adfærd på grund af faseovergange eller kemiske ændringer med temperaturen.
 Varme artikler
Varme artikler
-
 Registrering af flere sepsis -biomarkører fra fuldblod - hurtigt, nøjagtig, og billigeWyss Institute forskere har udviklet eRapid-teknologi som en affinitetsbaseret, lavpris elektrokemisk diagnostisk sensorplatform til multiplex påvisning af klinisk relevante sepsis biomarkører i fuldb
Registrering af flere sepsis -biomarkører fra fuldblod - hurtigt, nøjagtig, og billigeWyss Institute forskere har udviklet eRapid-teknologi som en affinitetsbaseret, lavpris elektrokemisk diagnostisk sensorplatform til multiplex påvisning af klinisk relevante sepsis biomarkører i fuldb -
 Smart lægemiddeldesign til at forhindre malariabehandlingsresistensKredit:CC0 Public Domain Resistens mod malaria kan undgås ved at studere, hvordan resistens udvikler sig under udvikling af lægemidler, ifølge et nyt blad offentliggjort i Cellekemisk biologi .
Smart lægemiddeldesign til at forhindre malariabehandlingsresistensKredit:CC0 Public Domain Resistens mod malaria kan undgås ved at studere, hvordan resistens udvikler sig under udvikling af lægemidler, ifølge et nyt blad offentliggjort i Cellekemisk biologi . -
 At vende et materiale på hovedet kan nogle gange gøre det blødereKunstnerisk fremstilling af det nye materiale. Kredit:ICN2 Gennem den kombinerede effekt af flexoelektricitet og piezoelektricitet, forskere ved ICN2 ledet af ICREA Gustau Catalán i samarbejde med
At vende et materiale på hovedet kan nogle gange gøre det blødereKunstnerisk fremstilling af det nye materiale. Kredit:ICN2 Gennem den kombinerede effekt af flexoelektricitet og piezoelektricitet, forskere ved ICN2 ledet af ICREA Gustau Catalán i samarbejde med -
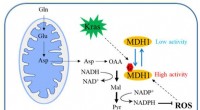 Forskere identificerer O-GlcNAcylering som årsag til bugspytkirteltumorvækst ved at regulere MDH1Skematisk diagram af, hvordan MDH1-glykosylering regulerer PDAC-vækst. Kredit:Zhejiang University Bugspytkirtelkræft er en yderst ondartet tumor i fordøjelsessystemet, og dens femårige overlevelses
Forskere identificerer O-GlcNAcylering som årsag til bugspytkirteltumorvækst ved at regulere MDH1Skematisk diagram af, hvordan MDH1-glykosylering regulerer PDAC-vækst. Kredit:Zhejiang University Bugspytkirtelkræft er en yderst ondartet tumor i fordøjelsessystemet, og dens femårige overlevelses
- Forudsigelse af fasestabiliteten af blødt stof
- Baltimore siger farvel til plastikposer ved kassen, starter i begyndelsen af næste år
- Påfuglfarver inspirerer til en grønnere måde at farve tøj på
- Kan fremtidens huse laves af bakterier?
- At finde den rette balance mellem vindenergi og biodiversitet
- Sådan ser du 5 planeter på linje på himlen lørdag morgen


