Hvor mange enlige elektronpar er der på nitrogen i ammoniak?
For at bestemme antallet af ensomme par på nitrogen skal vi overveje ammoniakens elektronkonfiguration og molekylære struktur. Nitrogen har fem valenselektroner, og i ammoniak danner det tre kovalente bindinger med tre brintatomer, der hver deler en elektron. Dette tegner sig for tre af nitrogenets fem valenselektroner.
De resterende to valenselektroner på nitrogen er ikke involveret i kovalent binding og danner et ensomt par. Disse ensomme elektronpar optager en orbital, der ikke er involveret i binding og er lokaliseret på nitrogenatomet.
Derfor er der et ensomt elektronpar til stede på nitrogen i ammoniak.
 Varme artikler
Varme artikler
-
 Nye materialer af perovskit udfordrer traditionelle forestillinger om højtrykskemiKemisk intuition fortæller os, at tryk har en tendens til at øge antallet af koordinering, og derfor normalt laver en struktur ordnet, der især gælder for perovskit-lignende forbindelser. Imidlertid,
Nye materialer af perovskit udfordrer traditionelle forestillinger om højtrykskemiKemisk intuition fortæller os, at tryk har en tendens til at øge antallet af koordinering, og derfor normalt laver en struktur ordnet, der især gælder for perovskit-lignende forbindelser. Imidlertid, -
 Kemikalieproducenter er imod nye tarifferKredit:CC0 Public Domain I juni, kemiske producenter konvergerede om Washington, D.C., at opfordre US Trade Representative Office (USTR) til at fjerne visse kemikalier fra en ny liste over toldsat
Kemikalieproducenter er imod nye tarifferKredit:CC0 Public Domain I juni, kemiske producenter konvergerede om Washington, D.C., at opfordre US Trade Representative Office (USTR) til at fjerne visse kemikalier fra en ny liste over toldsat -
 Bæredygtig transport:Rensning af luften på nitrogendopingAktive nitrogenatomer i kulstofkatalysatoren. Kredit:University of Tsukuba Proton-udvekslingsmembran (PEM) brændselsceller er en energilagringsteknologi, der vil hjælpe med at sænke transportens m
Bæredygtig transport:Rensning af luften på nitrogendopingAktive nitrogenatomer i kulstofkatalysatoren. Kredit:University of Tsukuba Proton-udvekslingsmembran (PEM) brændselsceller er en energilagringsteknologi, der vil hjælpe med at sænke transportens m -
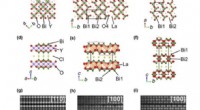 Teambilledressourcer brugt i internationalt eksperiment med nye fotokatalysatorerKredit:Skolkovo Institut for Videnskab og Teknologi Skoltech-forskere hjalp deres kolleger fra Japan, Tyskland, De Forenede Stater, og Kina studerer krystalstrukturen og optiske egenskaber af en n
Teambilledressourcer brugt i internationalt eksperiment med nye fotokatalysatorerKredit:Skolkovo Institut for Videnskab og Teknologi Skoltech-forskere hjalp deres kolleger fra Japan, Tyskland, De Forenede Stater, og Kina studerer krystalstrukturen og optiske egenskaber af en n
- NASA ser dannelsen af Tropical Storm Frances nær Darwin
- Mange børnepasningsudbydere står over for store økonomiske problemer som følge af pandemien
- Har vi ændret vores veje efter BP-olieudslippet? Ikke rigtig
- Nervelignende optiske blonder giver robotter et menneskeligt præg
- Facebook trækker sikkerhedsapp fra Apple Store over privatlivets fred (opdatering)
- Vil H-P beholde Palm på smartphonemarkedet?


