Hvad er volumen af metangas ved STP?
PV =nRT
Hvor:
P =tryk =1 atm
V =volumen (ukendt)
n =antal mol =1 mol
R =idealgaskonstant =0,08206 L*atm/mol*K
T =temperatur =273,15 K
Ved at løse for V får vi:
V =nRT/P
V =(1 mol) * (0,08206 L*atm/mol*K) * (273,15 K) / (1 atm)
V =22.414 L
Derfor er volumenet af 1 mol metangas ved STP 22,414 liter.
Sidste artikelEr natriumatom et isoleret atom?
Næste artikelButan og isobutan er eksempler på?
 Varme artikler
Varme artikler
-
 Molekylær dynamiksimulering kaster nyt lys over metanhydratdannelseMethanhydrat hentet fra havbunden ud for Oregons kyst, USA. Kredit:Wikimedia Commons I et papir, der blev offentliggjort i denne uge i PNAS , forskere ved University of Amsterdams Van t Hoff Ins
Molekylær dynamiksimulering kaster nyt lys over metanhydratdannelseMethanhydrat hentet fra havbunden ud for Oregons kyst, USA. Kredit:Wikimedia Commons I et papir, der blev offentliggjort i denne uge i PNAS , forskere ved University of Amsterdams Van t Hoff Ins -
 Porøse materialer måler temperatur på molekylært niveauKredit:CC0 Public Domain Forskere fra Gent Universitet undersøgte, hvordan såkaldte metal-organiske rammer ånder, når det bliver varmere eller koldere. Ved hjælp af avancerede computersimuleringer
Porøse materialer måler temperatur på molekylært niveauKredit:CC0 Public Domain Forskere fra Gent Universitet undersøgte, hvordan såkaldte metal-organiske rammer ånder, når det bliver varmere eller koldere. Ved hjælp af avancerede computersimuleringer -
 En forbedret metode til visualisering af proteinkrystalstrukturEn forbedret metode til visualisering af proteinkrystalstruktur. Kredit:Immanuel Kant Baltic Federal University Teknikken til visualisering af røntgenkrystalstruktur har været kendt i over hundred
En forbedret metode til visualisering af proteinkrystalstrukturEn forbedret metode til visualisering af proteinkrystalstruktur. Kredit:Immanuel Kant Baltic Federal University Teknikken til visualisering af røntgenkrystalstruktur har været kendt i over hundred -
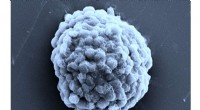 Forskning skaber brintproducerende levende dråber, bane vejen for alternativ fremtidig energikildeElektronmikroskopibillede af en tætpakket dråbe brintproducerende algeceller. Målestok, 10 mikrometer. Kredit:Prof Xin Huang, Harbin Institute of Technology Forskere har bygget små dråbebaserede m
Forskning skaber brintproducerende levende dråber, bane vejen for alternativ fremtidig energikildeElektronmikroskopibillede af en tætpakket dråbe brintproducerende algeceller. Målestok, 10 mikrometer. Kredit:Prof Xin Huang, Harbin Institute of Technology Forskere har bygget små dråbebaserede m
- Wireless World:For tidlige forudsigelser?
- Love Island:De psykologiske udfordringer, deltagere og seere kan stå over for, efter showet er slut…
- Demonstrer en 1-Pbps orbital vinkelmoment fiberoptisk transmission
- Hvorfor låntagere modsætter sig at bruge deres hjem som sikkerhed
- Kæledyrshunde og herreløse lider under hedebølgen i Asien
- Er calciumoxid en kovalent bundet forbindelse eller ionisk forbindelse?


