Hvad er forskellen i atomstruktur mellem to isotoper af klor?
1. Klor-35:Denne isotop har 17 protoner og 18 neutroner, hvilket giver den et massetal på 35. Det er den mest almindelige isotop af klor, der udgør omkring 75,77% af naturligt forekommende klor.
2. Klor-37:Denne isotop har også 17 protoner, men den har 20 neutroner, hvilket resulterer i et massetal på 37. Det er den mindre udbredte isotop af klor, der tegner sig for cirka 24,23 % af naturligt klor.
Med hensyn til deres atomare struktur er forskellen mellem chlor-35 og chlor-37 begrænset til neutrontallet. Begge isotoper har det samme antal protoner og elektroner, hvilket resulterer i identiske kemiske egenskaber. Deres adfærd og reaktivitet i kemiske reaktioner forbliver den samme uanset isotopen.
Variationen i neutrontal påvirker visse fysiske egenskaber af isotoperne. Klor-37 har en lidt højere atommasse sammenlignet med klor-35 på grund af dets yderligere neutroner. Denne forskel kan observeres i præcise målinger af atommasser og kan være nyttig til visse analytiske teknikker, såsom massespektrometri, som kan skelne mellem isotoper baseret på deres masse-til-ladning-forhold.
På trods af disse subtile fysiske forskelle er chlor-35 og chlor-37 kemisk ude af skel og opfører sig identisk i de fleste praktiske anvendelser. De deltager i de samme kemiske reaktioner og udviser de samme kemiske egenskaber, der er karakteristiske for klorelementet.
Sidste artikelHvad er forskellen mellem Curium 242 og 244?
Næste artikelForskellen mellem to isotoper af et grundstof?
 Varme artikler
Varme artikler
-
 Små porøse krystaller ændrer vandets form for at fremskynde kemiske reaktionerKemiske og biomolekylære ingeniørforskere fra University of Illinois undersøgte, hvordan vandmolekyler samles og ændrer form for at afsløre strategier, der fremskynder kemiske reaktioner, der er kriti
Små porøse krystaller ændrer vandets form for at fremskynde kemiske reaktionerKemiske og biomolekylære ingeniørforskere fra University of Illinois undersøgte, hvordan vandmolekyler samles og ændrer form for at afsløre strategier, der fremskynder kemiske reaktioner, der er kriti -
 Forskere viser en bedre, mere miljøvenlig metode til at fremstille brintoverilteUniversity of Illinois forskere demonstrerer en mere effektiv og miljøvenlig metode til at producere hydrogenperoxid med palladium-guld nanopartikler, en katalysator, som de fandt, fungerer bedre, når
Forskere viser en bedre, mere miljøvenlig metode til at fremstille brintoverilteUniversity of Illinois forskere demonstrerer en mere effektiv og miljøvenlig metode til at producere hydrogenperoxid med palladium-guld nanopartikler, en katalysator, som de fandt, fungerer bedre, når -
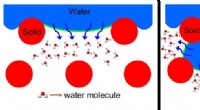 Forskere afslører nøgleindsigt i teknologien til fremvoksende vandrensningTil venstre repræsenterer en omnifobisk membran, og højre repræsenterer en konventionel hydrofob membran med øgede vand-luft-grænsefladeområder (grønne linjer). Kredit:Kota lab Med vandmangel er e
Forskere afslører nøgleindsigt i teknologien til fremvoksende vandrensningTil venstre repræsenterer en omnifobisk membran, og højre repræsenterer en konventionel hydrofob membran med øgede vand-luft-grænsefladeområder (grønne linjer). Kredit:Kota lab Med vandmangel er e -
 Forståelse og styring af det molekyle, der skabte universetMarcos Dantus, Universitets fremtrædende professor i kemi og fysik, har genskabt interstellare ioner med lasere. Kredit:MSU Trihydrogen, eller H 3 + , er anerkendt af videnskabsmænd som det mo
Forståelse og styring af det molekyle, der skabte universetMarcos Dantus, Universitets fremtrædende professor i kemi og fysik, har genskabt interstellare ioner med lasere. Kredit:MSU Trihydrogen, eller H 3 + , er anerkendt af videnskabsmænd som det mo
- Galakser viser appetit på vækst
- NZs passivitet med hensyn til bifangst af skildpadder i fiskeriet risikerer skade på omdømmet – læ…
- Hvordan kaffeindustrien er ved at blive ristet af klimaændringer
- En undersøgelse afslører, hvordan åndedrætsrør og kapillærer dannes
- Emballagen af DNA til kromosomer
- Forskere finder en måde at øge energikildenes kapacitet til bærbar elektronik


