Hvorfor har brom lavere bindingsentalpienergi end klor?
Der er et par grunde til, at brom har lavere bindingsentalpienergi end klor.
* Atomradius: Bromatomer er større end kloratomer. Det betyder, at elektronerne i en Br-Br-binding er mere spredt end elektronerne i en Cl-Cl-binding. Dette gør Br-Br-bindingen svagere.
* Elektronegativitet: Brom er mindre elektronegativt end klor. Det betyder, at bromatomer ikke tiltrækker elektroner så stærkt som kloratomer. Dette gør også Br-Br-bindingen svagere.
* Antal valenselektroner: Brom har flere valenselektroner end klor. Det betyder, at der er flere elektroner, der kan være involveret i Br-Br-bindingen. Dette gør Br-Br-bindingen stærkere.
Kombinationen af disse faktorer resulterer i, at brom har lavere bindingsentalpienergi end chlor.
Sidste artikelHvordan sammenligner brom atomradius klor?
Næste artikelHvad er metan i det periodiske system?
 Varme artikler
Varme artikler
-
 Udrydde et mærkeligt fænomen, der både hjælper og skader lithium-ion-batteriets ydeevneAli Sundermier En mystisk proces kaldet oxygenoxidation fjerner elektroner fra oxygenatomer i lithiumrige batterikatoder og forringer deres ydeevne, vist til venstre. Bedre forståelse af denne egenska
Udrydde et mærkeligt fænomen, der både hjælper og skader lithium-ion-batteriets ydeevneAli Sundermier En mystisk proces kaldet oxygenoxidation fjerner elektroner fra oxygenatomer i lithiumrige batterikatoder og forringer deres ydeevne, vist til venstre. Bedre forståelse af denne egenska -
 Ny molekylær fælde renser mere radioaktivt affald fra nukleare brændselsstaveWake Forest fysikprofessor Timo Thonhasuer taler med postdoc Stephanie Jensen om deres forskning i opsamling af radioaktive affaldsmaterialer i atomkraftværker. Kredit:WFU / Ken Bennett En ny meto
Ny molekylær fælde renser mere radioaktivt affald fra nukleare brændselsstaveWake Forest fysikprofessor Timo Thonhasuer taler med postdoc Stephanie Jensen om deres forskning i opsamling af radioaktive affaldsmaterialer i atomkraftværker. Kredit:WFU / Ken Bennett En ny meto -
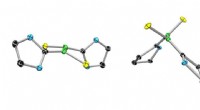 Generering af en stabil biradicalEn konventionel bor-bor dobbeltbinding (venstre) og dens ekstremt stabile biradiske slægtning. Kredit:Dr. Rian Dewhurst Bor har en række anvendelser, fra vaskeblegemiddel til varmebestandigt glas
Generering af en stabil biradicalEn konventionel bor-bor dobbeltbinding (venstre) og dens ekstremt stabile biradiske slægtning. Kredit:Dr. Rian Dewhurst Bor har en række anvendelser, fra vaskeblegemiddel til varmebestandigt glas -
 Forskning i brugsklar terapeutisk mad søger drastisk reduktion af dødsfald som følge af alvorlig …MIT kandidatstuderende Tonghan Gu (til højre) arbejder med teknikere på en facilitet i Vasai, Indien, at producere et parti brugsklare terapeutiske fødevarer i pulverform. Formlen, han har udviklet, b
Forskning i brugsklar terapeutisk mad søger drastisk reduktion af dødsfald som følge af alvorlig …MIT kandidatstuderende Tonghan Gu (til højre) arbejder med teknikere på en facilitet i Vasai, Indien, at producere et parti brugsklare terapeutiske fødevarer i pulverform. Formlen, han har udviklet, b
- Konservative kræfter: Hvad er det & hvorfor det betyder noget (w /eksempler)
- OnePlus lancerer sin første 5G-telefon i andet kvartal, men det starter ikke i USA
- Hvorfor øges DNA-indholdet under interfasen?
- Produktion af drop-in brændstof fra biomasse ved mikrobiel og elektrokemisk omdannelse
- Hvor dybt lever organismer i havet?
- Hvad blev jordens primitive atmosfære lavet af?


