Hvordan sammenligner brom atomradius klor?
Dette skyldes, at et grundstofs atomradius generelt stiger, når du går ned ad en gruppe i det periodiske system. Det skyldes, at antallet af elektronskaller stiger, efterhånden som man går ned i gruppen, og elektronerne i de ydre skaller bliver mindre stærkt tiltrukket af kernen. Som et resultat bliver atomerne større.
Brom er i samme gruppe som klor (gruppe 17), men det er en række under klor. Det betyder, at brom har en elektronskal mere end klor. Den ekstra elektronskal i brom gør atomerne større end klor.
Sidste artikelEr et kloratom større end brom?
Næste artikelHvorfor har brom lavere bindingsentalpienergi end klor?
 Varme artikler
Varme artikler
-
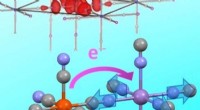 Ultrahurtig ladningsoverførsel i preussisk blå analogerKredit:Wiley Fotoinducerede ladningsoverførsler er en interessant elektronisk egenskab ved preussisk blå og nogle analogt strukturerede forbindelser. Et team af forskere har nu været i stand til a
Ultrahurtig ladningsoverførsel i preussisk blå analogerKredit:Wiley Fotoinducerede ladningsoverførsler er en interessant elektronisk egenskab ved preussisk blå og nogle analogt strukturerede forbindelser. Et team af forskere har nu været i stand til a -
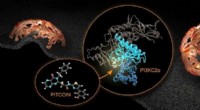 Inhibitor af lipidkinase PI3KC2a identificeret som potentiel ny behandling af tromboseKredit:Barth van Rossum Lipidkinasen PI3KC2a er et potentielt farmakologisk mål til behandling af trombose og muligvis cancer. Forskere fra Leibniz-Forschungsinstitut für Molekulare Pharmakologie (
Inhibitor af lipidkinase PI3KC2a identificeret som potentiel ny behandling af tromboseKredit:Barth van Rossum Lipidkinasen PI3KC2a er et potentielt farmakologisk mål til behandling af trombose og muligvis cancer. Forskere fra Leibniz-Forschungsinstitut für Molekulare Pharmakologie ( -
 Undersøgelse af vaping-partikelstørrelse og aflejringKredit:American Chemical Society Brugen af e-cigaretter er stigende, især blandt unge voksne og teenagere. Nylige sygdomme og dødsfald, der tilskrives vaping, har forårsaget intens undersøgelse
Undersøgelse af vaping-partikelstørrelse og aflejringKredit:American Chemical Society Brugen af e-cigaretter er stigende, især blandt unge voksne og teenagere. Nylige sygdomme og dødsfald, der tilskrives vaping, har forårsaget intens undersøgelse -
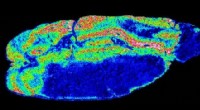 Konjugerede polymerer forbedrer massespektrometri og billeddannelseblå). Kredit:American Chemical Society Forbedringer i, hvordan prøver fremstilles, vil tilføje rækkevidde og fleksibilitet til en metode, der detekterer placeringen af udvalgte molekyler i en bi
Konjugerede polymerer forbedrer massespektrometri og billeddannelseblå). Kredit:American Chemical Society Forbedringer i, hvordan prøver fremstilles, vil tilføje rækkevidde og fleksibilitet til en metode, der detekterer placeringen af udvalgte molekyler i en bi
- Metalliske nanopartikler lyser op en anden vej mod miljøvenlige katalysatorer
- Metode fundet til at få fotoner til at frastøde hinanden i en ultrakold atomgas
- Hvordan man skriver en testbar hypotese
- Sådan finder du et sort hul
- Hjælp os med at finde ud af, hvordan vores muligvis beboelige exoplanet-nabo faktisk er
- Hvorfor det fjerne Antarktis er så vigtigt i en opvarmende verden


