Hvorfor er brom en bedre afgangsgruppe end klor?
1. Polariserbarhed: Brom er mere polariserbart end klor. Det betyder, at elektronskyen af brom lettere forvrænges, når den er bundet til et kulstofatom. Denne forvrængning svækker carbon-brom-bindingen, hvilket gør den mere tilbøjelig til at bryde under en substitutionsreaktion.
2. Elektronegativitet: Brom er mindre elektronegativt end klor. Det betyder, at brom har en lavere affinitet til elektroner end klor. Når et bromatom er bundet til et kulstofatom, er der mindre konkurrence om elektroner mellem kulstof- og bromatomerne. Denne svækkelse af bindingen mellem kulstof og brom letter afgangen af bromatomet under en substitutionsreaktion.
3. Bonddissociationsenergi: Kulstof-brombindingsdissociationsenergien (BDE) er lavere end kulstof-chlor-BDE. Det betyder, at det kræver mindre energi at bryde carbon-brom-bindingen end carbon-chlor-bindingen. Den lavere BDE af carbon-brom-bindingen bidrager til den større lethed af brom som en udgående gruppe.
4. Nukleofilicitet hos den afgående gruppe: Bromidionen (Br-) er en bedre nukleofil end chloridionen (Cl-). Dette betyder, at Br- er mere reaktiv og mere tilbøjelig til at deltage i reaktioner med andre molekyler. Den højere nukleofilicitet af bromidionen letter dens afgang fra molekylet under en substitutionsreaktion.
Samlet set gør kombinationen af disse faktorer - polariserbarhed, elektronegativitet, bindingsdissociationsenergi og nukleofilicitet af den fragående gruppe - brom til en bedre afgangsgruppe end chlor i substitutionsreaktioner.
Sidste artikelHvad sker der, når calciumcarbonat og saltsyre blandes?
Næste artikelHvorfor er brom og jod tættere end fluorklor?
 Varme artikler
Varme artikler
-
 Usædvanlig biosyntetisk vej tilbyder en nøgle til fremtidig naturlig produktopdagelseWilfred van der Donk, Richard E. Heckert begavet stol i kemi og direktør for kandidatstudier ved University of Illinois, og Howard Hughes Medical Institute Investigator. Kredit:L. Brian Stauffer B
Usædvanlig biosyntetisk vej tilbyder en nøgle til fremtidig naturlig produktopdagelseWilfred van der Donk, Richard E. Heckert begavet stol i kemi og direktør for kandidatstudier ved University of Illinois, og Howard Hughes Medical Institute Investigator. Kredit:L. Brian Stauffer B -
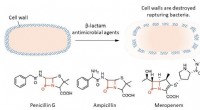 En ny synder i antibakteriel resistens:CysteinpersulfidØverst:β-lactam antimikrobielle midler sprænger bakterier ved at ødelægge deres cellevægge. Nederst:Den røde tekst i strukturformlen repræsenterer β-lactamringen, som er afgørende for bakteriedræbende
En ny synder i antibakteriel resistens:CysteinpersulfidØverst:β-lactam antimikrobielle midler sprænger bakterier ved at ødelægge deres cellevægge. Nederst:Den røde tekst i strukturformlen repræsenterer β-lactamringen, som er afgørende for bakteriedræbende -
 Forskere er ved at opdage måder at eliminere PFAS på, men dette voksende globale sundhedsproblem f…Kredit:Pixabay/CC0 Public Domain PFAS-kemikalier virkede som en god idé i starten. Som teflon gjorde de potter nemmere at rengøre fra 1940erne. De gjorde jakker vandtætte og gulvtæpper pletafvisend
Forskere er ved at opdage måder at eliminere PFAS på, men dette voksende globale sundhedsproblem f…Kredit:Pixabay/CC0 Public Domain PFAS-kemikalier virkede som en god idé i starten. Som teflon gjorde de potter nemmere at rengøre fra 1940erne. De gjorde jakker vandtætte og gulvtæpper pletafvisend -
 Ugiftig flammehæmmer kommer på markedetSkumprøve med EDA-DOPO i en flammetest i Empa laboratoriet. Kredit:Empa Kemikere fra Empa har udviklet og patenteret en miljøvenlig måde at fremstille flammehæmmere til skum, der kan bruges i madr
Ugiftig flammehæmmer kommer på markedetSkumprøve med EDA-DOPO i en flammetest i Empa laboratoriet. Kredit:Empa Kemikere fra Empa har udviklet og patenteret en miljøvenlig måde at fremstille flammehæmmere til skum, der kan bruges i madr
- Hvorfor kan vi ikke bare slæbe strandede hvaler og delfiner ud på havet igen?
- 737 MAX-katastrofen skubber Boeing i krisetilstand
- Kæmpe Taiwan Apple-leverandør TSMC står over for krænkelseskrav
- Langsigtet flodkemiundersøgelse afslører, hvordan Arktis ændrer sig
- Billede:Nødtræning på ISS
- 60-årig grænse for lasere væltet af kvanteforskere


