Hvorfor er h2so4 tyktflydende?
1. Hydrogenbinding:H2SO4-molekyler udviser stærk intermolekylær hydrogenbinding mellem hydrogenatomet i hydroxylgruppen og oxygenatomet i sulfatgruppen. Disse hydrogenbindinger skaber et netværk af interaktioner mellem molekyler, hvilket fører til øget modstand mod flow og en højere viskositet.
2. Polaritet:H2SO4 er et polært molekyle, hvilket betyder, at det har en delvis positiv ladning på brintatomerne og en delvis negativ ladning på iltatomerne. Molekylernes polære natur gør det muligt for dem at interagere med hinanden gennem elektrostatiske kræfter, hvilket yderligere øger viskositeten.
3. Koncentration:Svovlsyrens viskositet afhænger også af dens koncentration. Koncentreret svovlsyre har en højere viskositet sammenlignet med fortyndet svovlsyre. Når koncentrationen af H2SO4 stiger, stiger antallet af hydrogenbindinger og elektrostatiske interaktioner mellem molekyler, hvilket gør væsken mere tyktflydende.
4. Temperaturafhængighed:Svovlsyrens viskositet er omvendt relateret til temperaturen. Når temperaturen stiger, øges molekylernes kinetiske energi, hvilket får dem til at bevæge sig hurtigere og overvinde de intermolekylære kræfter. Dette resulterer i et fald i viskositeten med stigende temperatur.
5. Opløste arter:Tilstedeværelsen af opløste arter, såsom metalioner eller andre urenheder, kan også påvirke viskositeten af svovlsyre. Disse opløste arter kan interagere med syremolekylerne, ændre styrken og antallet af hydrogenbindinger og elektrostatiske interaktioner og derved påvirke viskositeten.
Samlet set bidrager kombinationen af stærk hydrogenbinding, polaritet, koncentration, temperaturafhængighed og opløste arter til svovlsyrens viskøse natur.
Sidste artikelHvordan får vi det svovl?
Næste artikelEr Windex en grundstofforbindelse eller blanding?
 Varme artikler
Varme artikler
-
 Undersøgelse afslører mysteriet om antimikrobielle frøsekretionerEt grafisk sammendrag:Elektrofysiologisk analyse af membranafbrydelse ved hjælp af Bombinin og dets isomer ved hjælp af Lipid Bilayer System. Kreditering:Figuren er tilpasset med tilladelse fra forsid
Undersøgelse afslører mysteriet om antimikrobielle frøsekretionerEt grafisk sammendrag:Elektrofysiologisk analyse af membranafbrydelse ved hjælp af Bombinin og dets isomer ved hjælp af Lipid Bilayer System. Kreditering:Figuren er tilpasset med tilladelse fra forsid -
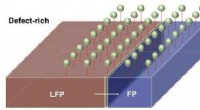 Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af
Forskere viser punktdefekter i katodekrystaller kan fremskynde lithiumabsorptionEn illustration viser et batteris katode, der gennemgår faseovergang fra jernfosfat (FP) til lithiumjernfosfat (LFP) under opladning. Simuleringer fra Rice University-forskere viste, at tilføjelse af -
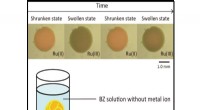 Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f
Less is more:En blød, selvbetjent pumpe for at forenkle mekatroniske enhederBelousov-Zhabotinsky hydrogel i opløsning. Kredit:Shibaura Institute of Technology Moderne mekatroniske enheder, fra industrimaskiner til robotter, har set en drastisk stigning i kompleksitet og f -
 Vi ved nu, hvordan insekter og bakterier kontrollerer isKredit:CC0 Public Domain I modsætning til hvad du måske er blevet lært, vand fryser ikke altid til is ved 32 grader F (nul grader C). Vidende, eller kontrollere, ved hvilken temperatur vand vil fr
Vi ved nu, hvordan insekter og bakterier kontrollerer isKredit:CC0 Public Domain I modsætning til hvad du måske er blevet lært, vand fryser ikke altid til is ved 32 grader F (nul grader C). Vidende, eller kontrollere, ved hvilken temperatur vand vil fr
- Hvad er reaktanterne og produkterne til cellulær respiration aerob?
- Udæmpet, udæmpet:Kampen om en unik europæisk flod
- Forskere bruger hydrofon til at lytte til metan siver i havet, håber næste estimere volumen
- Ørken økosystemer til børn
- Hvordan AI ændrer mellemlederes arbejde
- Hvor hot spots of genetic variation udviklede sig i humant DNA


