Hvordan kan du ændre væskens kogepunkt?
1. Tryk :Forøgelse af trykket på en væske hæver dens kogepunkt. Dette skyldes, at det højere tryk modvirker væskens damptryk, hvilket gør det sværere for molekylerne at undslippe og blive til damp. Omvendt sænkes kogepunktet ved at sænke trykket. Det er grunden til, at vand koger ved en lavere temperatur i højere højder, hvor det atmosfæriske tryk er lavere.
2. Urenheder :Tilsætning af ikke-flygtige urenheder til en væske hæver dens kogepunkt. Tilstedeværelsen af opløste partikler interfererer med udslip af opløsningsmiddelmolekyler, hvilket kræver en højere temperatur for at overvinde de intermolekylære kræfter og nå kogepunktet. Dette fænomen er kendt som kogepunktsstigning.
3. Kogepunktshøjdekonstant :Hvor meget kogepunktet hæves afhænger af arten af det opløste stof og opløsningens koncentration. Hvert opløsningsmiddel har sin karakteristiske kogepunktshøjdekonstant (Kb), som repræsenterer temperaturstigningen pr. molal koncentration af det opløste stof.
$$ΔT_b =K_b × m$$
Hvor:
- $$ΔT_b$$ =Kogepunktshøjde i Kelvin
- $$K_b$$ =Kogepunkts stigningskonstant for opløsningsmidlet i Kelvin pr. molal koncentration
- $$m$$ =Molal koncentration af opløsningen (mol opløst stof pr. kg opløsningsmiddel)
4. Kemisk struktur :Væskens kemiske struktur påvirker også dens kogepunkt. Væsker med stærkere intermolekylære kræfter, såsom hydrogenbinding, har tendens til at have højere kogepunkter. For eksempel har vand (H2O) et højere kogepunkt end ethanol (C2H5OH) på grund af tilstedeværelsen af stærk hydrogenbinding i vandmolekyler.
5. Kogepunktsdepression :Tilsætning af flygtige urenheder, såsom andre væsker, kan sænke en væskes kogepunkt. Dette fænomen er kendt som kogepunktsdepression. I dette tilfælde udøver den tilsatte flygtige forbindelse sit damptryk, konkurrerer med damptrykket af den oprindelige væske og letter dens fordampning.
Ved at forstå og manipulere disse faktorer er det muligt at kontrollere og justere væskers kogepunkt til forskellige praktiske anvendelser, såsom destillation, kogepunktsforhøjelse i frostvæskeopløsninger og kogepunktssænkning i azeotropiske blandinger.
 Varme artikler
Varme artikler
-
 Udforskning af fordelene ved defekter i laserfremstillede materialerKredit:CC0 Public Domain Metal additive manufacturing (AM) lover at revolutionere den måde, vi producerer og bruger visse dele på. Reducering af materialespild og arbejdstid, metal AM forenkler tr
Udforskning af fordelene ved defekter i laserfremstillede materialerKredit:CC0 Public Domain Metal additive manufacturing (AM) lover at revolutionere den måde, vi producerer og bruger visse dele på. Reducering af materialespild og arbejdstid, metal AM forenkler tr -
 Nanoplast kan forstyrre menneskelige lever- og lungecelleprocesser i laboratorieeksperimenterGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c03980 Hvad sker der, når folk ubevidst spiser, drikker eller inhalerer næsten usynlige plastikstykker? Selvo
Nanoplast kan forstyrre menneskelige lever- og lungecelleprocesser i laboratorieeksperimenterGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c03980 Hvad sker der, når folk ubevidst spiser, drikker eller inhalerer næsten usynlige plastikstykker? Selvo -
 En ny polyethylen-B4C baseret beton til afskærmningKredit:ESS/SINE2020 Afskærmning spiller en vigtig rolle ved neutronkilder for både strålingssikkerhed og for at minimere baggrundsstøj i neutronforsøg. Afskærmning er regelmæssigt lavet af beton,
En ny polyethylen-B4C baseret beton til afskærmningKredit:ESS/SINE2020 Afskærmning spiller en vigtig rolle ved neutronkilder for både strålingssikkerhed og for at minimere baggrundsstøj i neutronforsøg. Afskærmning er regelmæssigt lavet af beton, -
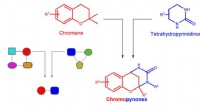 Inspirerende opdagelse af nye lægemidler med pseudo-naturprodukterDesign af chromopynon pseudo NPer. Fusion af chroman- og tetrahydropyrimidinonfragmenter. Kredit:MPI for molekylær fysiologi Næsten en tredjedel af de tilgængelige lægemidler er baseret på naturli
Inspirerende opdagelse af nye lægemidler med pseudo-naturprodukterDesign af chromopynon pseudo NPer. Fusion af chroman- og tetrahydropyrimidinonfragmenter. Kredit:MPI for molekylær fysiologi Næsten en tredjedel af de tilgængelige lægemidler er baseret på naturli
- Steder for Riemann -nuller måles nøjagtigt
- De fortvivlede guatemalanske kaffebønder drømmer om, at USA vender tilbage
- Genetiske stregkoder bruges til at kvantificere afgørende populationer i et koralrevøkosystem
- Tornadoer spinder op længere mod øst i USA, undersøgelse finder
- NASA finder Nisargas-rester over det centrale Indien
- Hoopoes' æg viser deres sande farver


