Hvordan er det muligt for en forbindelse at have både ioniske og kovalente bindinger?
Nogle eksempler på forbindelser med polære kovalente bindinger omfatter:
* Vand (H2O) :Forskellen i elektronegativitet mellem brint og oxygen er 1,4, hvilket er signifikant. Det betyder, at iltatomet i vand har en delvis negativ ladning, mens brintatomerne har en delvis positiv ladning.
* Hydrogenchlorid (HCl) :Forskellen i elektronegativitet mellem brint og klor er 0,9, hvilket også er signifikant. Det betyder, at kloratomet i hydrogenchlorid har en delvis negativ ladning, mens brintatomet har en delvis positiv ladning.
* Natriumchlorid (NaCl) :Forskellen i elektronegativitet mellem natrium og klor er 2,1, hvilket er meget stort. Det betyder, at natriumatomet i natriumchlorid har en meget stærk positiv ladning, mens kloratomet har en meget stærk negativ ladning.
Polære kovalente bindinger er meget vigtige i kemi. De er ansvarlige for egenskaberne af mange forskellige forbindelser, herunder vand, syrer og baser.
 Varme artikler
Varme artikler
-
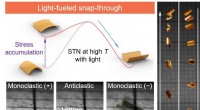 Molekylær switch muliggør fotomekanisk spring af polymererDen foto-inducerede bi-stabile struktur gør det muligt for den fotoaktive flydende krystallinske polymer at opnå snap-through inspireret spring. Effektiv fotoinduceret energiakkumulering og frigivelse
Molekylær switch muliggør fotomekanisk spring af polymererDen foto-inducerede bi-stabile struktur gør det muligt for den fotoaktive flydende krystallinske polymer at opnå snap-through inspireret spring. Effektiv fotoinduceret energiakkumulering og frigivelse -
 Ny undersøgelse kaster lys over molekylær bevægelseMolekylært bevægeligt billede. Kredit:University of Nottingham Ny forskning har vist, hvordan syntetiske selvfremstillede fibre kan lede molekylær bevægelse, der kan drives af lys over lange afsta
Ny undersøgelse kaster lys over molekylær bevægelseMolekylært bevægeligt billede. Kredit:University of Nottingham Ny forskning har vist, hvordan syntetiske selvfremstillede fibre kan lede molekylær bevægelse, der kan drives af lys over lange afsta -
 At dreje det periodiske system gennem 180 grader for et nyt perspektivKredit:University of Nottingham Kunne vende det periodiske system på hovedet gøre nogle vigtige aspekter lettere at forstå og begejstre flere for at studere kemi? Dette spørgsmål stilles i en art
At dreje det periodiske system gennem 180 grader for et nyt perspektivKredit:University of Nottingham Kunne vende det periodiske system på hovedet gøre nogle vigtige aspekter lettere at forstå og begejstre flere for at studere kemi? Dette spørgsmål stilles i en art -
 Forskere syntetiserer et nyt stof med antitumorale egenskaberLaboratoriet til syntese af naturlige produkter, hvor arbejdet er udført. Kredit:FEFUs pressekontor Forskere fra Far Eastern Federal University har udviklet et nyt syntetisk derivat af fascaplysin
Forskere syntetiserer et nyt stof med antitumorale egenskaberLaboratoriet til syntese af naturlige produkter, hvor arbejdet er udført. Kredit:FEFUs pressekontor Forskere fra Far Eastern Federal University har udviklet et nyt syntetisk derivat af fascaplysin
- Team afslører overraskende detaljer om afgørende energiproducerende enzym
- En kemiker laver 200 L af en opløsning med 62 procent syre. Han blander en 80 med 30 Hvor meget vil…
- ATLAS -eksperimentet søger efter charmerende forfald af Higgs -bosonen
- Rapporten sigter mod at forbedre bedste praksis inden for minerehabilitering
- Discovery hjælper med at vise, hvordan brystkræft spreder sig
- Caribisk bosættelse begyndte i de større Antiller, siger forskere


