Repræsenterer suffikset foran vandmolekyle et hydratnavn antal molekyler knyttet til ionforbindelse?
For eksempel i kobbersulfatpentahydrat betyder suffikset "penta", at der er fem vandmolekyler for hvert kobbersulfatmolekyle i hydratet. Tilsvarende betyder suffikset "deca" i natriumcarbonatdecahydrat, at der er ti vandmolekyler for hvert natriumcarbonatmolekyle i hydratet.
Antallet af vandmolekyler knyttet til en ionforbindelse i et hydrat bestemmes af koordinationssfæren af metalionen i forbindelsen. Koordinationssfæren er området omkring metalionen, der er optaget af ligander, som er molekyler eller ioner, der binder til metalionen.
Antallet af ligander, der kan koordinere til en metalion, bestemmes af størrelsen af metalionen, ladningen af metalionen og ligandernes steriske hindring. Sterisk hindring refererer til frastødningen mellem liganderne, der forhindrer dem i at komme for tæt på hinanden.
Generelt vil små metalioner med høj ladning have en større koordinationssfære end store metalioner med lav ladning. Dette skyldes, at de små metalioner er stærkere tiltrukket af liganderne og kan overvinde den steriske hindring mellem dem.
En metalions koordinationssfære kan også påvirkes af tilstedeværelsen af andre molekyler eller ioner i opløsningen. Hvis der for eksempel er mange andre molekyler eller ioner i opløsningen, kan de konkurrere med liganderne om binding til metalionen. Dette kan reducere antallet af ligander, der kan koordinere til metalionen og dermed antallet af vandmolekyler i hydratet.
Sidste artikelIndeholder en vandholdig forbindelse vand?
Næste artikelHvordan adskiller hydrat sig fra en vandfri ionforbindelse?
 Varme artikler
Varme artikler
-
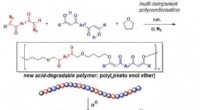 Ny syntetisk polymer nedbrydeligt under meget milde sure betingelserFremstilling af ny nedbrydelig syntetisk polymer. Kredit:Ehime University Et forskerhold ved Ehime University forberedte en ny type syntetisk polymer, som kan nedbrydes til en kombination af velde
Ny syntetisk polymer nedbrydeligt under meget milde sure betingelserFremstilling af ny nedbrydelig syntetisk polymer. Kredit:Ehime University Et forskerhold ved Ehime University forberedte en ny type syntetisk polymer, som kan nedbrydes til en kombination af velde -
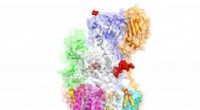 Cryo-EM afslører kritisk protein-modificerende kompleks og potentielt lægemiddelmålForskere har afsløret strukturen på atomniveau af et molekylært kompleks, der er ansvarligt for at modificere proteiner, muligvis baner vejen for udvikling af ny medicin mod kræft og en lang række and
Cryo-EM afslører kritisk protein-modificerende kompleks og potentielt lægemiddelmålForskere har afsløret strukturen på atomniveau af et molekylært kompleks, der er ansvarligt for at modificere proteiner, muligvis baner vejen for udvikling af ny medicin mod kræft og en lang række and -
 Ændringer i farve indikerer materialedeformationerEn revne, der ikke er synlig udefra, dannes og formerer sig inde i materialet. Ved det første tegn på skade, det begynder at fluorescere. Kredit: ACS Appl. Mater. Grænseflader ETH Zürich -forsker
Ændringer i farve indikerer materialedeformationerEn revne, der ikke er synlig udefra, dannes og formerer sig inde i materialet. Ved det første tegn på skade, det begynder at fluorescere. Kredit: ACS Appl. Mater. Grænseflader ETH Zürich -forsker -
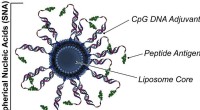 Vaccinedesign kan dramatisk forbedre kræftimmunoterapierDen mest succesfulde sfæriske nukleinsyre (SNA) i kræftimmunoterapivaccinen fik peptidantigenet spækket med DNA. Kredit:Shuya Wang/Northwestern University Når det kommer til effektiviteten af na
Vaccinedesign kan dramatisk forbedre kræftimmunoterapierDen mest succesfulde sfæriske nukleinsyre (SNA) i kræftimmunoterapivaccinen fik peptidantigenet spækket med DNA. Kredit:Shuya Wang/Northwestern University Når det kommer til effektiviteten af na
- NASAs nær-jord-asteroide CubeSat går fuld sejl
- Når vi er forbi frygtstadiet, hvor skal vi så lægge skylden for COVID-19-pandemien?
- Kunstige celler kommunikerer og samarbejder som biologiske celler, myrer (med video)
- Mobilapps kan måske få dig til at føle dig bedre til at rejse alene, men de vil ikke nødvendigvi…
- Udvikling af højholdbar enkeltatomisk katalysator ved hjælp af industriel luftfugter
- Luftkvalitetsmålinger på himlen over Europa


