Hvilken intermolekylær kraft vil mindst påvirke kogepunktet?
Kogepunktet er et mål for den temperatur, hvor damptrykket af en væske er lig med trykket omkring væsken, og væsken ændres til en damp. En væskes kogepunkt påvirkes af flere faktorer, herunder intermolekylære kræfter. Intermolekylære kræfter er de kræfter, der virker mellem molekyler. Der er tre hovedtyper af intermolekylære kræfter:hydrogenbinding, dipol-dipolkræfter og London-dispersionskræfter.
Hydrogenbinding er den stærkeste af de tre intermolekylære kræfter. Det opstår, når et hydrogenatom er bundet til et meget elektronegativt atom, såsom nitrogen, oxygen eller fluor. Dipol-dipol-kræfter opstår, når to molekyler har permanente dipoler. London spredningskræfter er den svageste af de tre intermolekylære kræfter. De opstår, når elektroner bevæger sig rundt om kernen af et atom og skaber en midlertidig dipol.
En væskes kogepunkt er direkte proportional med styrken af de intermolekylære kræfter mellem molekylerne. Jo stærkere intermolekylære kræfter, jo højere kogepunkt. Derfor ville hydrogenbinding påvirke kogepunktet mest, efterfulgt af dipol-dipol-kræfter og derefter London-spredningskræfter.
Sidste artikelHvilke funktionelle grupper er til stede i benzaldehyd?
Næste artikelHvad er de tre egenskaber ved en metallisk struktur?
 Varme artikler
Varme artikler
-
 Bygning fra gamle bygninger:Nedrivningsaffald bliver til ny betonDet franske firma Keey Aerogel kan producere sin aerogel-varmeisolering til omkring halvdelen af prisen ved at udvinde silica fra affaldsbeton i stedet for at bruge ny silica. Kredit:Keey Aerogel
Bygning fra gamle bygninger:Nedrivningsaffald bliver til ny betonDet franske firma Keey Aerogel kan producere sin aerogel-varmeisolering til omkring halvdelen af prisen ved at udvinde silica fra affaldsbeton i stedet for at bruge ny silica. Kredit:Keey Aerogel -
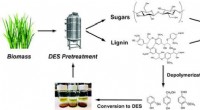 Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan
Vedvarende opløsningsmidler afledt af lignin sænker spild i biobrændstofproduktionBioraffinaderi-konceptet, der bruger fornybare dybe eutektiske opløsningsmidler (DES) afledt af ligninråvarer, er vist her. Kredit:US Department of Energy Et bioraffinaderi med lukket kredsløb kan -
 Kuldetilpassede enzymer kan transformeres ved stuetemperaturKredit:CC0 Public Domain Enzymer fra kulde-elskende organismer, der lever ved lave temperaturer, tæt på vands frysepunkt, udviser meget karakteristiske egenskaber. I en ny undersøgelse offentliggj
Kuldetilpassede enzymer kan transformeres ved stuetemperaturKredit:CC0 Public Domain Enzymer fra kulde-elskende organismer, der lever ved lave temperaturer, tæt på vands frysepunkt, udviser meget karakteristiske egenskaber. I en ny undersøgelse offentliggj -
 Søger de mest effektive polymerer til personligt beskyttelsesudstyrBrug fluorescens til at demonstrere, hvordan partikler binder forskelligt til forskellige materialetyper. Kredit:Morgan Alexander Personligt beskyttelsesudstyr, som ansigtsmasker og kjoler, er gen
Søger de mest effektive polymerer til personligt beskyttelsesudstyrBrug fluorescens til at demonstrere, hvordan partikler binder forskelligt til forskellige materialetyper. Kredit:Morgan Alexander Personligt beskyttelsesudstyr, som ansigtsmasker og kjoler, er gen
- Hvordan vil Canada håndtere sine naturbrande i fremtiden?
- Vurdering af kvantepunktfotoemissioner
- Er beskeden blevet viral? Skyld det på altruistiske, men alligevel billedbevidste internet-'e-maven…
- En mere kollektiv forståelse af kystsystemers dynamik og evolution
- Hvorfor falder biomassen?
- Rollespil for internationalt personale udstationeret i konfliktzoner giver træning i bløde færdig…


