Hvor mange gange surere er en opløsning med pH 1 end at have 2?
pH-skalaen er en logaritmisk skala, der bruges til at måle surheden eller basiciteten af en opløsning. Det er defineret som den negative logaritme (base 10) af hydrogenionkoncentrationen i mol pr. liter.
En opløsning med en pH på 1 har en hydrogenionkoncentration på 10^(-1) M, mens en opløsning med en pH på 2 har en hydrogenionkoncentration på 10^(-2) M.
Derfor er opløsningen med pH 1 10 gange surere end opløsningen med pH 2.
For en forskel på n pH-enheder kan forskellen i hydrogenionkoncentration generelt beregnes ved hjælp af formlen:
[H+] højere / [H+] lavere =10^n
Så for en forskel på 1 pH-enhed (fra 2 til 1) er den højere hydrogenionkoncentration 10 gange den lavere hydrogenionkoncentration.
 Varme artikler
Varme artikler
-
 Løsningsbehandlede OLED'er baner vejen for fremtidige belysningsapplikationerKredit:Shutterstock Før det kan overtage vores gader og hjem, OLED-belysning skal gøres mere tilgængelig. SOLEDLIGHT-projektet har udviklet nye flerlags OLEDer takket være en ny proces, der lover
Løsningsbehandlede OLED'er baner vejen for fremtidige belysningsapplikationerKredit:Shutterstock Før det kan overtage vores gader og hjem, OLED-belysning skal gøres mere tilgængelig. SOLEDLIGHT-projektet har udviklet nye flerlags OLEDer takket være en ny proces, der lover -
 Fra kompost til kompositter:En miljøvenlig måde at forbedre gummi påKredit:American Chemical Society Begrebet fra skrald til skat gælder for komposteringens verden, hvor madaffald genanvendes til gødning til haver. Men hvad nu hvis kompost kunne gå ud over gødning
Fra kompost til kompositter:En miljøvenlig måde at forbedre gummi påKredit:American Chemical Society Begrebet fra skrald til skat gælder for komposteringens verden, hvor madaffald genanvendes til gødning til haver. Men hvad nu hvis kompost kunne gå ud over gødning -
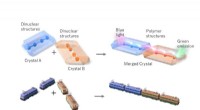 Linkede lanthanider skinner lys på krystalteknikNår blåt lys skinner på dysprosiumenden af forbundne lanthanidkrystaller (blå krystal), lyser terbiumenden (orange krystal) grønt. Dette sammenlignes med et tog, der transporterer energi. Kredit:Ped
Linkede lanthanider skinner lys på krystalteknikNår blåt lys skinner på dysprosiumenden af forbundne lanthanidkrystaller (blå krystal), lyser terbiumenden (orange krystal) grønt. Dette sammenlignes med et tog, der transporterer energi. Kredit:Ped -
 Elektrodeposition og udglødning bruges til at muliggøre justering af hårdhed i nanokornede metall…Mikrostruktur af den aflejrede nanokornede Ni-Mo-legering. (A) Bright-field og (B) dark-field billeder af den afsatte Ni-21,5% Mo prøve. (Indsæt) Et tilsvarende valgt områdediffraktionsmønster. (C) Et
Elektrodeposition og udglødning bruges til at muliggøre justering af hårdhed i nanokornede metall…Mikrostruktur af den aflejrede nanokornede Ni-Mo-legering. (A) Bright-field og (B) dark-field billeder af den afsatte Ni-21,5% Mo prøve. (Indsæt) Et tilsvarende valgt områdediffraktionsmønster. (C) Et
- Undersøgelse af klimaændringernes indvirkning på energisystemer i både global og regional skala
- Jordskælv i slowmotion:At studere slow-slip begivenheder kan kaste lys over ødelæggende storme
- Sådan fungerer Caterpillar rendegravere
- Er du sikker, hr. Heisenberg? Nye målinger uddyber forståelsen af kvanteusikkerhed
- Hvordan fungerer fraktioneret destillation?
- Et bedre billeddannelsesmiddel til hjertesygdomme og brystkræft


