Hvorfor holdes ioner sammen i en ionbinding?
For eksempel er ionbindingen mellem natrium og klor i natriumchlorid (NaCl) meget stærk, fordi natriumionen har en ladning på +1 og chloridionen har en ladning på -1, og ionerne er meget tæt på hinanden i krystallen gitter.
Ionbindinger dannes typisk mellem et metal og et ikke-metal. Metalatomerne mister elektroner til ikke-metalatomerne, hvilket resulterer i dannelsen af positive og negative ioner. Ionerne tiltrækkes derefter af hinanden og holdes sammen af den elektrostatiske tiltrækningskraft.
Ionbindinger er stærke og stabile, hvorfor ionforbindelser typisk er hårde og sprøde. Ioniske forbindelser har også høje smeltepunkter og kogepunkter.
Sidste artikelHvad er laboratoriepræparatet til metan?
Næste artikelHvor mange molekyler er der i 2,10 mol kuldioxid?
 Varme artikler
Varme artikler
-
 En vej til fremtiden, belagt med keramikReeja Jayan og hendes forskerhold undersøger, hvordan elektromagnetiske felter fremskynder keramisk fremstilling, finde både udfordringer og stort potentiale. Kredit:College of Engineering, Carnegie M
En vej til fremtiden, belagt med keramikReeja Jayan og hendes forskerhold undersøger, hvordan elektromagnetiske felter fremskynder keramisk fremstilling, finde både udfordringer og stort potentiale. Kredit:College of Engineering, Carnegie M -
 Biologisk materiale øger solcellens ydeevneCongcong Wu, forskningslektor ved Penn State, arbejder med materialer, der kan indsættes i næste generation af solceller for at forbedre deres effektivitet. Perovskite solceller er et område med inten
Biologisk materiale øger solcellens ydeevneCongcong Wu, forskningslektor ved Penn State, arbejder med materialer, der kan indsættes i næste generation af solceller for at forbedre deres effektivitet. Perovskite solceller er et område med inten -
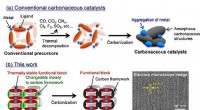 En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern
En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern -
 I glødende farver:At se spredningen af narkotikapartikler i et retsmedicinsk laboratoriumNIST-forskere brugte glødende pulver til at forstå, hvordan lægemiddelpartikler kan spredes på overflader i et retskemisk laboratorium. Kredit:E. Sisco, M. Staymates/NIST Da to videnskabsmænd fra
I glødende farver:At se spredningen af narkotikapartikler i et retsmedicinsk laboratoriumNIST-forskere brugte glødende pulver til at forstå, hvordan lægemiddelpartikler kan spredes på overflader i et retskemisk laboratorium. Kredit:E. Sisco, M. Staymates/NIST Da to videnskabsmænd fra
- UK afsiger første dom over 3-D-printet våben
- Facebook-udviklerkonference starter midt i en skandale
- Nyt AI-værktøj fanger, hvordan proteiner opfører sig i kontekst
- At finde takten til kollektive dyrebevægelser:Forskere viser, at gensidighed er nøglen til at driv…
- Ikke så fantastisk engangsplastik for at få en miljøvenlig makeover
- Røde Havs klimaudsigter:Håndteres med forsigtighed


