Hvorfor leder ioniske forbindelser opløst i vand en elektrisk strøm?
Når en elektrisk strøm ledes gennem opløsningen, kan disse solvatiserede ioner bevæge sig frit mod de modsat ladede elektroder. De positivt ladede natriumioner (kationer) bevæger sig mod katoden (negativ elektrode), mens de negativt ladede chloridioner (anioner) bevæger sig mod anoden (positiv elektrode). Denne bevægelse af ioner udgør en elektrisk strøm, der strømmer gennem opløsningen.
Derfor tillader tilstedeværelsen af frit bevægende ioner i opløsningen ioniske forbindelser opløst i vand til at lede en elektrisk strøm.
Sidste artikelHvad er mere sur svovlsyre eller salpetersyre?
Næste artikelHvad er ligningen mellem ammoniumcarbonat og kaliumhydroxid?
 Varme artikler
Varme artikler
-
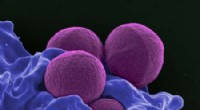 Fiskeslim:En uudnyttet kilde til potentielle nye antibiotikaEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Efterhånden som de nuværende antibiotika svinder i effektivitet mod multiresistente patog
Fiskeslim:En uudnyttet kilde til potentielle nye antibiotikaEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Efterhånden som de nuværende antibiotika svinder i effektivitet mod multiresistente patog -
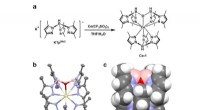 Dybblå organiske lysemitterende dioder baseret på et dublet-emission cerium(III) kompleksen. Syntetisk rute for komplekset. b. Enkeltkrystalstruktur af komplekset vist som ellipsoider ved 50 % sandsynlighedsniveau, hvor gul repræsenterer Ce, pink repræsenterer B, blå repræsenterer N, rød
Dybblå organiske lysemitterende dioder baseret på et dublet-emission cerium(III) kompleksen. Syntetisk rute for komplekset. b. Enkeltkrystalstruktur af komplekset vist som ellipsoider ved 50 % sandsynlighedsniveau, hvor gul repræsenterer Ce, pink repræsenterer B, blå repræsenterer N, rød -
 Fra bånd til rulning:Få formkontrol ved elektrostatikC16-K1 samling billeder, der viser høje aspekt transformationer til cochleate med stigende saltkoncentration. Kredit:Northwestern University Northwestern Engineering materialevidenskabelige forske
Fra bånd til rulning:Få formkontrol ved elektrostatikC16-K1 samling billeder, der viser høje aspekt transformationer til cochleate med stigende saltkoncentration. Kredit:Northwestern University Northwestern Engineering materialevidenskabelige forske -
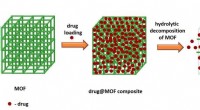 Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu
Bare tilsæt vand:Kemikere foreslår en løsning for uopløselige lægemidlerPå billedet er en skematisk repræsentation af et lægemiddel indkapslet i MOF, efterfulgt af den øjeblikkelige frigivelse af lægemidlet fra dets sammensætning. Kredit:Adam Matzger og Suresh Kuruthu
- Hvad er det koldeste sted i universet?
- Sweat equity:Campus rekreation fører til akademiske præstationer og fastholdelse, siger undersøge…
- Sådan holder du egern af din Deck
- Facebook siger, at der ikke er noget tegn, som den seneste hack spredte sig til andre apps
- Digitale nomader ønsker at erstatte nationalstaten – er der en mørkere side af denne søgen efter …
- Hvordan varm tun (og nogle hajer) holder sig varm


