Hvad sker der med vandmolekyler, når elektricitet ledes igennem under elektrolyse?
1. Dissociation :Vandmolekylerne er opdelt i deres bestanddele:brint (H2) og oxygen (O2). Denne proces er kendt som elektrolyse af vand.
2. Danning af brintgas :Ved katoden (negativ elektrode) tiltrækkes hydrogenioner (H+) fra vandmolekyler til elektroden og får elektroner til at blive til brintgas (H2). Hydrogenatomerne kombineres derefter og danner brintmolekyler.
3. Danning af iltgas :Ved anoden (positiv elektrode) gennemgår vandmolekyler en anden reaktion. Her mister hydroxidioner (OH-) fra vandet elektroner, hvilket får iltatomerne til at kombineres til iltgas (O2). Disse oxygenatomer danner oxygenmolekyler (O2) og frigives fra anoden.
4. Elektrolyt :For at lette elektrolyseprocessen tilsættes normalt en elektrolyt til vandet. Denne elektrolyt kan være en syre, en base eller et salt, og dens tilstedeværelse hjælper med at forbedre vandets ledningsevne og øger effektiviteten af elektrolyseprocessen.
5. Bobler :Efterhånden som elektrolysen fortsætter, dannes der bobler af brint og oxygengas ved de respektive elektroder, som stiger til vandoverfladen. Brintboblerne samles ved katoden, mens iltboblerne samles ved anoden.
Den overordnede kemiske reaktion for elektrolyse af vand kan repræsenteres som følger:
2H2O(l) → 2H2(g) + O2(g)
Sammenfattende, når en elektrisk strøm ledes gennem vand under elektrolyse, dissocierer vandmolekylerne til brint og oxygengasser. Hydrogengas produceres ved katoden, og oxygengas produceres ved anoden. Disse gasser kan derefter opsamles og bruges til forskellige formål.
 Varme artikler
Varme artikler
-
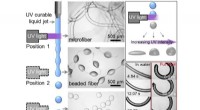 Høst af mikropartikler fra en flydende stråleAfhængigt af placeringen af UV -bestrålingen af væskestrålen, fibre, beaded fibre eller mikropartikler dannes. Kredit:University of Twente Mikrosfærer, mikrolinser og mikrofibre kan nu fremsti
Høst af mikropartikler fra en flydende stråleAfhængigt af placeringen af UV -bestrålingen af væskestrålen, fibre, beaded fibre eller mikropartikler dannes. Kredit:University of Twente Mikrosfærer, mikrolinser og mikrofibre kan nu fremsti -
 Stabile perovskite LED'er et skridt nærmereHeyong Wang, Ph.D.-studerende ved Linköpings Universitet. Kredit:Magnus Johansson Forskere ved Linköpings Universitet, arbejde med kolleger i Storbritannien, Kina og Tjekkiet, har udviklet en pero
Stabile perovskite LED'er et skridt nærmereHeyong Wang, Ph.D.-studerende ved Linköpings Universitet. Kredit:Magnus Johansson Forskere ved Linköpings Universitet, arbejde med kolleger i Storbritannien, Kina og Tjekkiet, har udviklet en pero -
 Livet af et skumTre eksperimenter om bord på Maxus 6-sonderaketten vil undersøge skumets egenskaber. Maxus 6-sonende raket er planlagt til opsendelse fra Esrange, Swedish Space Corporation raketbase nær Kiruna, i det
Livet af et skumTre eksperimenter om bord på Maxus 6-sonderaketten vil undersøge skumets egenskaber. Maxus 6-sonende raket er planlagt til opsendelse fra Esrange, Swedish Space Corporation raketbase nær Kiruna, i det -
 Forskere fremstiller alsidig katalysator til polyestersyntese og nedbrydningZn(HMDS)2 som en alsidig transesterificeringskatalysator til polyestersyntese og nedbrydning. Kredit:XU Guangqiang Hvid forurening fra kasseret plastaffald er et af de mest presserende miljøproble
Forskere fremstiller alsidig katalysator til polyestersyntese og nedbrydningZn(HMDS)2 som en alsidig transesterificeringskatalysator til polyestersyntese og nedbrydning. Kredit:XU Guangqiang Hvid forurening fra kasseret plastaffald er et af de mest presserende miljøproble
- En perovskitbaseret diode, der er i stand til både lysemission og detektion
- Hvad er årsagen til, at spændingen falmer i lithiumrige NMC-katodematerialer?
- Teenagemuseumsundervisere øger engagementet, læring, i tween besøgende
- Mysteriet med ultra-diffuse svage galakser løst
- Hvordan man kan forbedre vandkvaliteten i Europa
- Hvordan planter videregiver genetiske minder


