Danner 0,1 mol HCl og 0,2 NaOH en buffer?
I dette tilfælde har vi 0,1 mol HCl (en stærk syre) og 0,2 mol NaOH (en stærk base). Når disse to stoffer reagerer, vil de gennemgå en neutraliseringsreaktion, hvilket resulterer i dannelsen af vand og et salt (NaCl).
HCl + NaOH -> NaCl + H2O
Da HCl er en stærk syre, vil den dissociere fuldstændigt i vand og frigive H+ ioner. NaOH, som er en stærk base, vil dissociere fuldstændigt i vand og frigive OH-ioner. Den resulterende opløsning vil indeholde en høj koncentration af enten H+ eller OH- ioner, afhængigt af den overskydende reaktant.
Derfor vil blandingen af 0,1 mol HCl og 0,2 mol NaOH ikke danne en buffer, fordi den mangler en svag syre-konjugeret base eller et svagt base-konjugat syrepar, som er nødvendigt for buffervirkning. I stedet vil opløsningen sandsynligvis være sur på grund af overskydende H+ ioner fra HCl.
Sidste artikelDefiner kvanteudbytte af en fotokemisk reaktion?
Næste artikelEr NaF surt basisk eller et salt?
 Varme artikler
Varme artikler
-
 Bionedbrydelige plantebeskyttelsesmidler uden risici eller bivirkningerEt hold fra det tekniske universitet i München (TUM) har udviklet et biologisk nedbrydeligt middel, der holder skadedyr på afstand uden at forgifte dem:som myggemiddel, der bruges af badende om sommer
Bionedbrydelige plantebeskyttelsesmidler uden risici eller bivirkningerEt hold fra det tekniske universitet i München (TUM) har udviklet et biologisk nedbrydeligt middel, der holder skadedyr på afstand uden at forgifte dem:som myggemiddel, der bruges af badende om sommer -
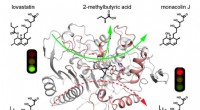 Forskere afslører den katalytiske mekanisme af lovastatinhydrolaseLovastatinhydrolase PcEST katalyserer specifikt og effektivt omdannelsen af lovastatin til monacolin J, men kan ikke hydrolysere simvastatin Kredit:LIANG Yajing Hyperlipidæmi, en af de mest al
Forskere afslører den katalytiske mekanisme af lovastatinhydrolaseLovastatinhydrolase PcEST katalyserer specifikt og effektivt omdannelsen af lovastatin til monacolin J, men kan ikke hydrolysere simvastatin Kredit:LIANG Yajing Hyperlipidæmi, en af de mest al -
 Deep-UV-probing-metoden detekterer elektronoverførsel i solcelleanlægKredit:iStock fotos Sensibiliserede solceller bestående af en molekylær eller solid-state sensibilisator, der tjener til at opsamle lys og injicere en elektron i et substrat, der favoriserer deres
Deep-UV-probing-metoden detekterer elektronoverførsel i solcelleanlægKredit:iStock fotos Sensibiliserede solceller bestående af en molekylær eller solid-state sensibilisator, der tjener til at opsamle lys og injicere en elektron i et substrat, der favoriserer deres -
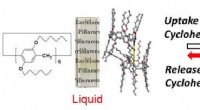 Damp driver en væske -fast overgang i et molekylært systemFigur 1. Skematisk illustration af cyclohexan gæstedampinduceret tilstandsændring af søjle [6] arene med 12 n-hexylgrupper. Kredit:Kanazawa University Den reversible omskiftning af makrocykliske m
Damp driver en væske -fast overgang i et molekylært systemFigur 1. Skematisk illustration af cyclohexan gæstedampinduceret tilstandsændring af søjle [6] arene med 12 n-hexylgrupper. Kredit:Kanazawa University Den reversible omskiftning af makrocykliske m
- Hvad sker der med et molekyle fra protein under fordøjelsen?
- Menneskelig hjerne supercomputer med 1 million processorer tændt for første gang
- Kæledyr? Selskabsdyr? Etikere siger, at udtrykket betyder noget
- Sådan fungerer kloning
- Hvilke ændringer finder sted, når et stof gennemgår faseskift?
- Ny undersøgelse beskriver, hvordan den kemiske sammensætning af amerikansk luftforurening har ænd…


