Hvilke observationer gør du, når du reagerer kaliumhydroxid med natriumcarbonat?
Når kaliumhydroxid (KOH) og natriumcarbonat (Na2CO3) blandes, kan følgende observationer gøres:
1. Brusning: Reaktionen mellem KOH og Na2CO3 producerer kuldioxidgas (CO2) som et af produkterne. Denne gas får bobler til at dannes og stige til overfladen af blandingen, hvilket resulterer i opbrusning. Frigivelsen af CO2-gas indikerer, at en kemisk reaktion finder sted.
2. Danning af kaliumcarbonat: Reaktionen mellem KOH og Na2CO3 resulterer i dannelsen af kaliumcarbonat (K2CO3), som er et hvidt fast stof. Efterhånden som reaktionen skrider frem, kan K2CO3 fælde ud af opløsningen afhængigt af reaktionens koncentrationer og betingelser.
3. Ændring i pH: Kaliumhydroxid er en stærk base, mens natriumcarbonat er en mild base. Når den blandes, har den resulterende opløsning en tendens til at være basisk på grund af tilstedeværelsen af hydroxidioner (OH-) fra KOH. Blandingens pH vil være højere end for rent vand.
4. Varmeproduktion: Reaktionen mellem KOH og Na2CO3 er eksoterm, hvilket betyder, at den frigiver varme. Denne varmeudvikling kan få blandingens temperatur til at stige, især hvis reaktionen udføres i koncentreret form.
5. Ændringer i opløselighed: Afhængigt af de anvendte koncentrationer kan de dannede produkter (K2CO3) påvirke opløseligheden af andre arter, der er til stede i blandingen. Dette kan føre til dannelse af bundfald eller ændringer i opløseligheden af eksisterende forbindelser.
Det er vigtigt at bemærke, at de nøjagtige observationer kan variere afhængigt af de specifikke forhold og koncentrationer af de anvendte reaktanter.
Sidste artikelHvilke elementer findes i kuglepen?
Næste artikelHar natriumhydrogencarbonat en lavere pH end hydroxid?
 Varme artikler
Varme artikler
-
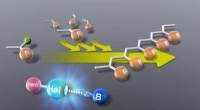 Fremstilling af fremtiden med en ny miljøvenlig polymeriseringsmetodeHalogenbindende organokatalysatorer (R-Hal-B) lettede jævn levende kationisk polymerisation af vinyl (R-Cl) monomerer ved stuetemperatur, producerer en god mængde rent udbytte, åbne døre for at opnå m
Fremstilling af fremtiden med en ny miljøvenlig polymeriseringsmetodeHalogenbindende organokatalysatorer (R-Hal-B) lettede jævn levende kationisk polymerisation af vinyl (R-Cl) monomerer ved stuetemperatur, producerer en god mængde rent udbytte, åbne døre for at opnå m -
 Diagnose af ikke-invasiv prostatakræft, overvågningPh.d. studerende Parissa Ziaei forbereder silica -nanospringe til et apparat til påvisning af prostatakræft i Su Has laboratorium på Gene and Linda Voiland School of Chemical Engineering and Bioengine
Diagnose af ikke-invasiv prostatakræft, overvågningPh.d. studerende Parissa Ziaei forbereder silica -nanospringe til et apparat til påvisning af prostatakræft i Su Has laboratorium på Gene and Linda Voiland School of Chemical Engineering and Bioengine -
 Nye optiske brintsensorer eliminerer risikoen for gnistdannelseKredit:CC0 Public Domain Brint som et rent, vedvarende alternativ til fossile brændstoffer er en del af en fremtid med bæredygtig energi, og meget allerede her. Imidlertid, dvælende bekymringer om
Nye optiske brintsensorer eliminerer risikoen for gnistdannelseKredit:CC0 Public Domain Brint som et rent, vedvarende alternativ til fossile brændstoffer er en del af en fremtid med bæredygtig energi, og meget allerede her. Imidlertid, dvælende bekymringer om -
 Effektiv titanium-baseret katalysator, der bruges til at producere PEF, biobaseret alternativ til PE…Kredit:Angewandte Chemie En mulig erstatning for drikkevarebeholdere lavet af PET er polyethylenfurandicarboxylat (PEF), fremstillet af vedvarende ressourcer. Produktionen af råvaren til PEF fra
Effektiv titanium-baseret katalysator, der bruges til at producere PEF, biobaseret alternativ til PE…Kredit:Angewandte Chemie En mulig erstatning for drikkevarebeholdere lavet af PET er polyethylenfurandicarboxylat (PEF), fremstillet af vedvarende ressourcer. Produktionen af råvaren til PEF fra
- Sætter levnedsberegner til handling
- Ion billard cue ny materialesyntesemetode
- Hvordan at slippe af med flagermus i Chimney
- USA øger presset på Europa over 5G-infrastruktur fra Kinas Huawei
- Ekstrem varme ændrer, hvordan folk oplever udendørslivet
- Verden har brug for grønnere vandpolitik, når efterspørgslen stiger:FN


