Hvad er processen med neutraliseringsprocessen?
Her er en trin-for-trin forklaring af neutraliseringsprocessen:
1. Blanding af syre og base:Når en syre og en base blandes, dissocierer syrens molekyler i vand for at frigive H+ ioner, mens basens molekyler dissocieres for at frigive OH- ioner.
2. Ionudveksling:H+ ionerne fra syren og OH- ionerne fra basen reagerer med hinanden og danner vandmolekyler (H2O) gennem en proces kaldet protonoverførsel. Denne reaktion er repræsenteret som:
H+ + OH- -> H2O
3. Saltdannelse:Da H+ og OH- ionerne forbruges i dannelsen af vand, forbliver de positivt ladede ioner fra basen (kationer) og de negativt ladede ioner fra syren (anionerne) i opløsningen. Disse ioner kombineres og danner et salt.
4. Afslutning af reaktion:Neutraliseringsreaktionen fortsætter, indtil alle H+ ioner fra syren og alle OH- ioner fra basen er blevet forbrugt, hvilket resulterer i fuldstændig neutralisering af syren og basen.
5. pH-værdi:pH-værdien af den resulterende opløsning afhænger af styrken af den anvendte syre og base. Hvis syren og basen er stærke, vil pH være tæt på 7, hvilket indikerer en neutral opløsning. Hvis syren eller basen er svag, kan pH være sur eller basisk, afhængigt af reaktanternes relative styrker.
Generelt involverer neutraliseringsprocessen reaktionen mellem H+-ioner og OH-ioner til dannelse af vand og et salt, hvilket fører til dannelsen af en neutral eller let sur eller basisk opløsning.
 Varme artikler
Varme artikler
-
 Fysikere får ny indsigt i nanosystemer med sfærisk indeslutningBipolær struktur samlet af stive polymerer ved lave tætheder. Kredit:Arash Nikoubashman, Mainz Universitet Teoretiske fysikere ledet af professor Kurt Binder og Dr. Arash Nikoubashman ved Johannes
Fysikere får ny indsigt i nanosystemer med sfærisk indeslutningBipolær struktur samlet af stive polymerer ved lave tætheder. Kredit:Arash Nikoubashman, Mainz Universitet Teoretiske fysikere ledet af professor Kurt Binder og Dr. Arash Nikoubashman ved Johannes -
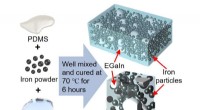 Nyt smart materiale fungerer bedre under presSkematisk af proceduren til fremstilling af den flydende metalfyldte magnetoreologiske elastomer Kredit:Yun et al Avancerede robotfølsomme berøringsenheder eller næste generations bærbare enheder
Nyt smart materiale fungerer bedre under presSkematisk af proceduren til fremstilling af den flydende metalfyldte magnetoreologiske elastomer Kredit:Yun et al Avancerede robotfølsomme berøringsenheder eller næste generations bærbare enheder -
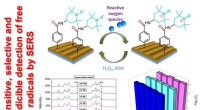 Forskere skaber sensorer med fælder til frie radikalerSensor drift diagram. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University og partnere fra Tjekkiet og Frankrig har designet ekstremt følsomme sensorer til frie iltholdi
Forskere skaber sensorer med fælder til frie radikalerSensor drift diagram. Kredit:Tomsk Polytekniske Universitet Forskere fra Tomsk Polytechnic University og partnere fra Tjekkiet og Frankrig har designet ekstremt følsomme sensorer til frie iltholdi -
 Samspillet mellem kemiske spejlbillederChristian Merten arbejder på Bochum Institut for Organisk Kemi II og er medlem af Cluster of Excellence Resolv. Kredit:RUB, Kramer Kemikere fra Ruhr-Universität Bochum håber at finde ud af, hvor s
Samspillet mellem kemiske spejlbillederChristian Merten arbejder på Bochum Institut for Organisk Kemi II og er medlem af Cluster of Excellence Resolv. Kredit:RUB, Kramer Kemikere fra Ruhr-Universität Bochum håber at finde ud af, hvor s
- Måling af molekylære interaktioner
- Forskere afslører permafrostens dynamik og klimapåvirkninger i tibetanske alpine græsarealer
- EU vil tvinge internetvirksomheder til at fjerne terrorindhold
- Udforske det sociale i skolealderen, følelsesmæssig, og adfærdsmæssigt sundhedslandskab
- Sådan: Ukorrekte fraktioner i korrekte fraktioner
- Hvad er et patent egentlig?


