Hvilken har den stærkeste intermolekylære kraft NH3 eller H20?
Både H2O og NH3 er polære molekyler. Elektronegativiteten af nitrogen- og oxygenatomer er henholdsvis 3,0 og 3,5. Så oxygen-hydrogen-bindingen i H2O er mere polær end nitrogen-hydrogen-bindingen i NH3. Som et resultat kan H2O-molekyler danne stærkere hydrogenbindinger med hinanden.
De stærkere hydrogenbindinger i H2O fører til højere kogepunkt, højere smeltepunkt og højere overfladespænding sammenlignet med NH3.
Sidste artikelHvad har den største intermolekylære kraft vand eller ethanol?
Næste artikelIoniske forbindelser dannes generelt mellem?
 Varme artikler
Varme artikler
-
 Høje magnetiske felter styrer både hastighed og produkt af kemiske reaktionerSkematisk diagram af magnetfelt, der kontrollerer kemisk reaktionshastighed og produkter. Kredit:DING Wei For nylig, ved hjælp af den SM1 superledende magnet, et stort videnskabeligt apparat med e
Høje magnetiske felter styrer både hastighed og produkt af kemiske reaktionerSkematisk diagram af magnetfelt, der kontrollerer kemisk reaktionshastighed og produkter. Kredit:DING Wei For nylig, ved hjælp af den SM1 superledende magnet, et stort videnskabeligt apparat med e -
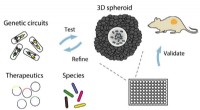 Forskere udvikler en ny platform, der genskaber kræft i et fad for hurtigt at bestemme den bedste b…Bakterier koloniserer multicellulære sfæroider in vitro, hvor de screenes for vækst, kredsløb dynamik, og terapeutisk effekt og derefter valideres i musetumormodeller. Kredit:Tetsuhiro Harimoto/Columb
Forskere udvikler en ny platform, der genskaber kræft i et fad for hurtigt at bestemme den bedste b…Bakterier koloniserer multicellulære sfæroider in vitro, hvor de screenes for vækst, kredsløb dynamik, og terapeutisk effekt og derefter valideres i musetumormodeller. Kredit:Tetsuhiro Harimoto/Columb -
 Forskere udvikler computermodel til at forudsige, om et pesticid vil skade bierGrafik viser en AI-tilgang til at bestemme, om et foreslået nyt pesticid er giftigt for honningbier baseret på dets molekylære struktur. Kredit:Cory Simon, Oregon State University Forskere fra Oreg
Forskere udvikler computermodel til at forudsige, om et pesticid vil skade bierGrafik viser en AI-tilgang til at bestemme, om et foreslået nyt pesticid er giftigt for honningbier baseret på dets molekylære struktur. Kredit:Cory Simon, Oregon State University Forskere fra Oreg -
 Nyt materiale gør køleudstyr mere energieffektiveTil deres prøver, de dækkede en konventionel varmeveksler (som brugt i kommercielt køleudstyr) med det nye materiale, i samarbejde med kolleger fra Fraunhofer Institute for Solar Energy Systems. Kredi
Nyt materiale gør køleudstyr mere energieffektiveTil deres prøver, de dækkede en konventionel varmeveksler (som brugt i kommercielt køleudstyr) med det nye materiale, i samarbejde med kolleger fra Fraunhofer Institute for Solar Energy Systems. Kredi
- Californien spænder for kraftige vinde, der kan nære brande
- De tidligste dyr udviklede sig senere end antaget
- Nyt 3-D mikrofluid system giver større kontrol over produktionen af nanopartikler, der leverer læ…
- Sådan løses polynomiske ligninger
- Hvad menes der med ækvi-kohæsiv temperatur?
- Argentinsk marskland truet af de værste brande i årtier


