Hvorfor ville germanium og arsen ikke være mest ens?
Hovedårsagen til, at germanium og arsen ikke er mere ens, er, at de har forskellige elektroniske konfigurationer. Germanium har fire valenselektroner, mens arsen har fem. Denne forskel i elektronisk konfiguration fører til forskellige kemiske egenskaber. For eksempel er det mere sandsynligt, at germanium danner kovalente bindinger, mens arsen er mere tilbøjelige til at danne ionbindinger.
Derudover har germanium og arsen forskellige atomradier. Germanium har en atomradius på 122 picometer, mens arsen har en atomradius på 115 picometer. Denne forskel i atomare radier fører til forskellige fysiske egenskaber. For eksempel er germanium tættere end arsen.
Derfor, mens germanium og arsen begge er gruppe 14-elementer, har de ganske forskellige egenskaber på grund af deres forskellige elektroniske konfigurationer og atomare radier.
Sidste artikelHvad bruges de 5 ting ammoniak til?
Næste artikelEr det at reagere med ilt en fysisk egenskab ved brint?
 Varme artikler
Varme artikler
-
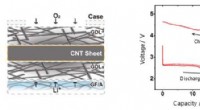 Udvikling af lithium-luft-batterier med ultrahøj kapacitet ved brug af CNT-arkluftelektroderKonceptuelt diagram af en CNT-arkluftelektrode (venstre) og opladnings-afladningskarakteristika for lithium-luftbatteriet med ultrahøj kapacitet (højre). Kredit:National Institute for Materials Scienc
Udvikling af lithium-luft-batterier med ultrahøj kapacitet ved brug af CNT-arkluftelektroderKonceptuelt diagram af en CNT-arkluftelektrode (venstre) og opladnings-afladningskarakteristika for lithium-luftbatteriet med ultrahøj kapacitet (højre). Kredit:National Institute for Materials Scienc -
 Forskere udvikler luftkvalitetssensor, der kan redde liv for babyer og astmapatienterKredit:CC0 Public Domain Forskere ved University of Sussex har samarbejdet med et Oxford -firma, M-SOLV, og et team af forskere fra hele Europa for at udvikle et meget følsomt og præcist nitrogend
Forskere udvikler luftkvalitetssensor, der kan redde liv for babyer og astmapatienterKredit:CC0 Public Domain Forskere ved University of Sussex har samarbejdet med et Oxford -firma, M-SOLV, og et team af forskere fra hele Europa for at udvikle et meget følsomt og præcist nitrogend -
 Effektiv kædeoverførsel til 3D-print af robuste fotopolymererKredit:Wiley Et stadigt voksende antal belægninger, inklusive lakker og trykfarver, samt tandfyldninger, hærdes med lys. Endnu, homogen, skræddersyet, polymernetværk kan ikke fremstilles, og mater
Effektiv kædeoverførsel til 3D-print af robuste fotopolymererKredit:Wiley Et stadigt voksende antal belægninger, inklusive lakker og trykfarver, samt tandfyldninger, hærdes med lys. Endnu, homogen, skræddersyet, polymernetværk kan ikke fremstilles, og mater -
 Forskere fanger molekylære kort over dyrevæv med hidtil usete detaljerDon Smith er medlem af forskningsfakultetet ved National High Magnetic Field Laboratory. Kredit:Stephen Bilenky Vi har alle hørt, og set, hvordan et billede tegner tusind ord. Nu, i en videnskabel
Forskere fanger molekylære kort over dyrevæv med hidtil usete detaljerDon Smith er medlem af forskningsfakultetet ved National High Magnetic Field Laboratory. Kredit:Stephen Bilenky Vi har alle hørt, og set, hvordan et billede tegner tusind ord. Nu, i en videnskabel
- Hvordan forbehandlingsmetoder påvirker omdannelseseffektiviteten af biomasseenergiproduktion
- Russiske embedsmænd siger, at luftlækage på den internationale rumstation ikke udgør nogen fare …
- Raffineringssystemer, der bruges til at lave guldstænger
- Hvordan undersøgelser af den fotokemiske interaktion af UV-stråling med RNA kan optimeres
- Forskere opdaterer fire centrale fundamentale konstanter
- Smarte bilteknologier sparer bilister 6,2 milliarder dollars i brændstofomkostninger hvert år


