I reaktionen mellem sølvnitrat og natriumchlorid, hvor mange gram vil der blive produceret fra 100 g, når det blandes med et overskud af klorid?
AgNO3 + NaCl → AgCl + NaNO3
Først skal vi konvertere den givne masse af sølvnitrat (100 g) til mol ved hjælp af dens molære masse (169,87 g/mol):
Mol AgNO3 =100 g / 169,87 g/mol =0,583 mol
Dernæst skal vi beregne de maksimale mol sølvchlorid, der kan fremstilles ud fra 0,583 mol sølvnitrat. Fra støkiometrien af den balancerede ligning ved vi, at 1 mol AgNO3 reagerer med 1 mol AgCl. Derfor kan 0,583 mol AgNO3 maksimalt producere 0,583 mol AgCl.
Nu skal vi tjekke, om der er nok natriumchlorid til at reagere med alt sølvnitrat. Da problemet siger, at der er et overskud af klorid, kan vi antage, at der er mere end nok natriumchlorid til rådighed.
Derfor er den begrænsende reaktant sølvnitrat, og alt det vil blive forbrugt i reaktionen. Det maksimale antal mol fremstillet sølvchlorid vil være 0,583 mol.
Til sidst konverterer vi mol sølvchlorid tilbage til gram ved hjælp af dens molære masse (143,32 g/mol):
Gram AgCl =0,583 mol * 143,32 g/mol =83,68 g
Når 100 g sølvnitrat blandes med overskydende natriumchlorid, vil der derfor blive produceret 83,68 g sølvchlorid.
Sidste artikelHvad sker der, når sølvnitrat tilsættes bariumchlorid?
Næste artikelEr de fleste faste stoffer tætte og svære at komprimere?
 Varme artikler
Varme artikler
-
 Ultrahurtig kompression tilbyder en ny måde at få makromolekyler ind i cellerneBilledet viser en mikrofluidisk chip, hvortil der er tilføjet farvestof for at vise kanalerne. Ved at behandle levende celler som små svampe, forskere har udviklet en potentielt ny måde at introducere
Ultrahurtig kompression tilbyder en ny måde at få makromolekyler ind i cellerneBilledet viser en mikrofluidisk chip, hvortil der er tilføjet farvestof for at vise kanalerne. Ved at behandle levende celler som små svampe, forskere har udviklet en potentielt ny måde at introducere -
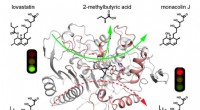 Forskere afslører den katalytiske mekanisme af lovastatinhydrolaseLovastatinhydrolase PcEST katalyserer specifikt og effektivt omdannelsen af lovastatin til monacolin J, men kan ikke hydrolysere simvastatin Kredit:LIANG Yajing Hyperlipidæmi, en af de mest al
Forskere afslører den katalytiske mekanisme af lovastatinhydrolaseLovastatinhydrolase PcEST katalyserer specifikt og effektivt omdannelsen af lovastatin til monacolin J, men kan ikke hydrolysere simvastatin Kredit:LIANG Yajing Hyperlipidæmi, en af de mest al -
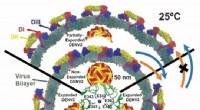 Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in
Dengue -infektion korrelerer med dynamik snarere end morfologierKredit:National University of Singapore NUS -biofysikere har opdaget nye konformationsændringer og strukturelle dynamikker af denguevirus under deres overførsel til menneskelige værter. Dengue-in -
 At træne får hydrogeler til at fungere mere som musklerEn mekanisk trænet kunstig muskel modstår beskadigelse (revne) forplantning ved hjælp af justerede nanofibriller, en lignende træthedsbestandig mekanisme som i skeletmuskler. Kredit:Ji Liu, Shaoting L
At træne får hydrogeler til at fungere mere som musklerEn mekanisk trænet kunstig muskel modstår beskadigelse (revne) forplantning ved hjælp af justerede nanofibriller, en lignende træthedsbestandig mekanisme som i skeletmuskler. Kredit:Ji Liu, Shaoting L
- Skovbrande raser i det svulmende Californien
- Reaktion på naturkatastrofer som Harvey kunne hjælpes med spilteori
- Video:Hvad er hvid chokolade?
- Sådan laver du Place Value Charts for Students
- Lancering af ny teknologi? Hvordan træffer du datadrevne beslutninger uden salgsdata?
- Fremtidens superledende magneter


