Hvorfor er hydrogenbindinger mellem HF-molekyler stærkere end HBr- og HI-HCl-molekylerne?
I tilfælde af hydrogenbindinger mellem HF-molekyler er elektronegativiteten af fluor den højeste blandt halogenerne, hvilket betyder, at den har den stærkeste tiltrækning for elektroner. Dette skaber en stærk delvis positiv ladning på hydrogenatomet i HF, som igen kan danne en stærkere hydrogenbinding med det enlige elektronpar på et andet fluoratom.
Til sammenligning har HBr- og HI-molekyler henholdsvis svagere elektronegative brom- og jodatomer. Dette resulterer i en svagere delvis positiv ladning på brintatomet, hvilket fører til svagere hydrogenbindinger.
Derudover giver den mindre størrelse af fluoratomet i HF mulighed for tættere nærhed mellem hydrogen- og fluoratomerne, hvilket yderligere styrker hydrogenbindingen.
Ydermere er polariteten af HF-bindingen højere end den for H-Br- og H-I-bindinger på grund af den højere elektronegativitetsforskel mellem hydrogen og fluor. Denne øgede polaritet giver mulighed for stærkere elektrostatiske interaktioner mellem hydrogenbindingsdonoren og acceptoren, hvilket resulterer i en stærkere hydrogenbinding.
Derfor bidrager kombinationen af høj elektronegativitet, lille molekylstørrelse og høj bindingspolaritet til de stærkere hydrogenbindinger mellem HF-molekyler sammenlignet med HBr- og HI-molekyler.
Sidste artikelHvorfor er kogepunktet for H2O højere end HF?
Næste artikelHvilken slags bindinger brydes, når HF fordamper?
 Varme artikler
Varme artikler
-
 Ny teknik til at skabe super-svampe er en game changerForskere har udtænkt nye metoder til postsyntetisk modifikation af metal-organiske rammer for at producere egenskaber i materialet, der er ideelt til gasmanipulation. Kredit:DGIST Metal-organiske
Ny teknik til at skabe super-svampe er en game changerForskere har udtænkt nye metoder til postsyntetisk modifikation af metal-organiske rammer for at producere egenskaber i materialet, der er ideelt til gasmanipulation. Kredit:DGIST Metal-organiske -
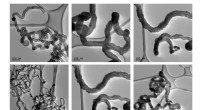 Fra genbrug til upcycling:En smartere måde at håndtere plast påEksempler på carbon nanorør produceret med den nye tilgang, ved forskellige forstørrelser. Kredit:RMIT University Globalt genbruges kun omkring 20% af affaldsplast. At øge dette tal er stadig en
Fra genbrug til upcycling:En smartere måde at håndtere plast påEksempler på carbon nanorør produceret med den nye tilgang, ved forskellige forstørrelser. Kredit:RMIT University Globalt genbruges kun omkring 20% af affaldsplast. At øge dette tal er stadig en -
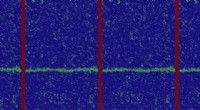 Forståelse af den grundlæggende karakter af atomare skala defekterEn molekylær simulering af en korngrænse (grøn), der migrerer. Kredit:Penn Engineering Materialeforskere studerer metaller, polymerer, og andre stoffer på atomniveau for at finde nye måder at kont
Forståelse af den grundlæggende karakter af atomare skala defekterEn molekylær simulering af en korngrænse (grøn), der migrerer. Kredit:Penn Engineering Materialeforskere studerer metaller, polymerer, og andre stoffer på atomniveau for at finde nye måder at kont -
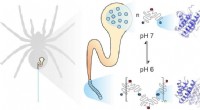 Dynamikken af silkeproteiner er nøglen til enestående stabilitet af edderkoppesilke som biomater…Edderkoppesilke er sammensat af individuelle proteiner. Mekaniske og kemiske faktorer påvirker, hvordan de samles. Underenhedernes dynamik spiller en vigtig rolle. Kredit:Benedikt Goretzki, Ute Hellmi
Dynamikken af silkeproteiner er nøglen til enestående stabilitet af edderkoppesilke som biomater…Edderkoppesilke er sammensat af individuelle proteiner. Mekaniske og kemiske faktorer påvirker, hvordan de samles. Underenhedernes dynamik spiller en vigtig rolle. Kredit:Benedikt Goretzki, Ute Hellmi
- Ti fakta om varme ørkener
- Sådan fungerer det metriske system
- NASA-NOAA-satellitten finder tropisk storm Kiko i form
- Galileo Galileis opfindelse og bidrag
- Forskere udvikler en diagnostisk test, som har til formål at påvise antibiotikaresistens på mindr…
- Kompleksitetstest giver nyt perspektiv på små kvantecomputere


