Dynamikken af silkeproteiner er nøglen til enestående stabilitet af edderkoppesilke som biomateriale
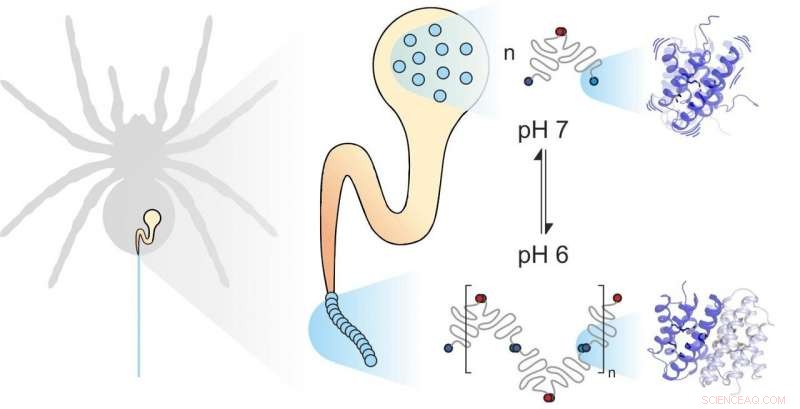
Edderkoppesilke er sammensat af individuelle proteiner. Mekaniske og kemiske faktorer påvirker, hvordan de samles. Underenhedernes dynamik spiller en vigtig rolle. Kredit:Benedikt Goretzki, Ute Hellmich
Edderkoppesilke består af fiberdannende proteiner, opbevaret af edderkoppen i en specialiseret kirtel. Når edderkoppen har brug for silke, for eksempel at bygge et web, det ekstruderer silkeproteinerne gennem en lang kanal, hvori de udsættes for specifikke mekaniske og kemiske påvirkninger og samles til silke. edderkoppesilkeproteiner, ligesom alle proteiner, består af 20 elementære byggesten kendt som aminosyrer. Antallet og rækkefølgen af disse aminosyrer bestemmer egenskaberne af individuelle proteiner. For eksempel, hvis hydrofobe aminosyrer såsom leucin er placeret i midten af et protein, resultatet er betydelig strukturel stabilitet. Du kan derfor forvente, at den ekstremt stærke edderkoppesilke indeholder meget leucin. Til deres store overraskelse, imidlertid, videnskabsmænd fra universiteterne i Mainz og Würzburg opdagede, at en anden byggesten, methionin, er meget rigeligt i nogle edderkoppesilkeproteiner.
Methionin-sidekæder er kendt for at være meget fleksible. "Det var denne overflod af methionin i edderkoppesilkeproteinet, der fik os til at se nærmere på dets dynamik, " sagde professor Ute Hellmich fra Johannes Gutenberg University Mainz (JGU). "Vores samarbejde med teamet af Dr. Hannes Neuweiler ved Julius-Maximilians-Universität Würzburg (JMU) gav os adgang til state-of-the-art biofysiske forskningsværktøjer. "
Würzburg-gruppen erstattede systematisk aminosyren methionin i edderkoppesilkeproteiner med leucin og sammenlignede foldningen, stabilitet, og dynamik af de resulterende proteinvarianter ved hjælp af foto-induceret elektronoverførselsfluorescens-korrelationsspektroskopi (PET-FCS). Dr. Hannes Neuweiler var medvirkende til udviklingen af denne teknik, og hans laboratorium er førende i verden i at bruge det til at undersøge biologiske systemer. Professor Ute Hellmichs team undersøgte derefter strukturen og dynamikken af de to proteinvarianter ved hjælp af højopløsningskernemagnetisk resonans (NMR) spektroskopi. "Vi udfører vores NMR-målinger ved Center for Biomolekylær Magnetisk Resonans ved Goethe-Universitetet i Frankfurt - endnu et eksempel på potentialet, der genereres af vores samarbejde i Rhine-Main University-netværket, " understregede Hellmich.
Methioninbyggesten i edderkoppesilkeproteiner giver fleksibilitet
Kombinationen af PET-FCS og NMR-spektroskopi førte de to forskergrupper til den uventede konklusion, at methionin i edderkoppesilkeprotein øger fleksibiliteten af proteinstrukturen, og at denne fleksibilitet netop er det, der gør det muligt for de enkelte proteiner i edderkoppesilke at interagere tæt. "Vi fandt ud af, at substituering af methionin med leucin ikke har nogen effekt på edderkoppesilkeproteinstrukturen. Faktisk, begge proteiner ser nøjagtig ens ud. På samme tid, imidlertid, det naturlige methioninholdige protein binder sig meget stærkere til andre edderkoppesilkeproteiner. Det leucinholdige protein, vi syntetiserede i laboratoriet, mister stort set denne evne til at danne sådanne stabile forbindelser, " påpegede Benedikt Goretzki, en ph.d.-kandidat i Hellmichs team og en af de to hovedforfattere af undersøgelsen offentliggjort i Naturkommunikation . "Vi var virkelig overraskede, da dette viser, at det ikke kun er formen af et protein, der bestemmer, hvordan det fungerer, men også, i betydelig grad, dens fleksibilitet."
"Methionin gør ikke kun proteinet mere dynamisk, det forbedrer også dets funktionalitet. Træde i kræft, det gør det muligt for to proteiner at forbindes specifikt med hinanden, hvilket ellers ville være umuligt, selvom de havde samme struktur, " præciserede Julia Heiby, ph.d.-kandidat i Neuweilers gruppe og den anden hovedforfatter til undersøgelsen.
"Form følger funktion" er en tommelfingerregel i strukturbiologien. Med andre ord, hvad et protein normalt gør, kan udledes af dets tredimensionelle struktur. "Det er imponerende, hvordan naturen også kan påvirke proteinernes funktion ved præcist at tilpasse deres dynamik, " tilføjede den Mainz-baserede biokemiker professor Ute Hellmich.
På baggrund af disse resultater, det kan nu være muligt selektivt at ændre egenskaberne af edderkoppesilkeproteiner, for eksempel, at syntetisere nye meget stabile biomaterialer. Ud over, de to grupper håber også at give generel indsigt i relevansen af proteiners dynamik i forhold til deres biologiske funktioner. "Protein dynamik er vigtig i alle aspekter af livet, " konkluderede Hellmich. "Dette gælder både for edderkopper og mennesker."
 Varme artikler
Varme artikler
-
 Hydrogel-baserede kapsler kan udvide sig og opholde sig i mave-tarmkanalen i dagevis, langsomt frigi…Jinyao Liu, venstre, og Giovanni Traverso strækker en ny hydrogel. For at sikre, at patienterne får deres fulde behandlingsforløb, forskere har udviklet et nyt sæt lægemiddelleveringsmaterialer lavet
Hydrogel-baserede kapsler kan udvide sig og opholde sig i mave-tarmkanalen i dagevis, langsomt frigi…Jinyao Liu, venstre, og Giovanni Traverso strækker en ny hydrogel. For at sikre, at patienterne får deres fulde behandlingsforløb, forskere har udviklet et nyt sæt lægemiddelleveringsmaterialer lavet -
 En værktøjskasse til at skabe nye lægemidlerDenne svamp er fuld af overraskelser:jack-o-lanterne-svampen lyser i mørket og producerer peptider, der kan være nyttige for mennesker. Kredit:Noah Siegel, wikicommons, CC BY-SA 3.0 ETH mikrobiolo
En værktøjskasse til at skabe nye lægemidlerDenne svamp er fuld af overraskelser:jack-o-lanterne-svampen lyser i mørket og producerer peptider, der kan være nyttige for mennesker. Kredit:Noah Siegel, wikicommons, CC BY-SA 3.0 ETH mikrobiolo -
 Bestemmelse af atomstrukturen af naturlige produkter hurtigere og mere præcistMåling af den resterende kemiske skiftanisotropi i et flydende krystallinsk medium. Metoden blev brugt til at bestemme stereokemien af spiroepicoccin A, et nyligt opdaget naturprodukt. Det nye natur
Bestemmelse af atomstrukturen af naturlige produkter hurtigere og mere præcistMåling af den resterende kemiske skiftanisotropi i et flydende krystallinsk medium. Metoden blev brugt til at bestemme stereokemien af spiroepicoccin A, et nyligt opdaget naturprodukt. Det nye natur -
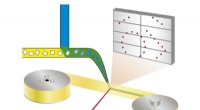 Ny metode muliggør automatiseret hurtig undersøgelse af enzymatiske processerPrincip for bland-og-diffus seriel synkrotronkrystallografi:Proteinkrystaller blandes med en opløsning af en lægemiddelkandidat og røntgenstråles på et bånd, der løber gennem røntgenstrålen. Kredit:Be
Ny metode muliggør automatiseret hurtig undersøgelse af enzymatiske processerPrincip for bland-og-diffus seriel synkrotronkrystallografi:Proteinkrystaller blandes med en opløsning af en lægemiddelkandidat og røntgenstråles på et bånd, der løber gennem røntgenstrålen. Kredit:Be
- Eksperter:Idaho -rugeri, der er bygget for at redde laks, dræber dem
- NASA finder Nardas-rester, der bringer regn til Mexico, på vej til det sydvestlige USA
- Nanokatalysator er en gas:Ny formel kan gøre brændstofproduktionen bedre, grønnere
- Diagnosticering af brystkræft ved hjælp af rødt lys
- At omdanne en knivspids salt til en elektrisk kontakt
- At finde en tabt planet, på størrelse med Neptun


