Hvorfor reagerer kaliumnitrat og sukker, så det producerer røg?
1. Oxidations-reduktionsreaktion:
- Kaliumnitrat virker som et oxidationsmiddel, der giver ilt til forbrænding af sukker.
- Sukker fungerer som brændstof, der giver kulstof og brint til reaktionen.
- Under reaktionen kombineres kulstofatomerne i sukker med ilt fra kaliumnitrat for at danne kuldioxid (CO2) gas.
- Hydrogenatomerne i sukker kombineres med ilt og danner vanddamp (H2O).
2. Dekomponering:
- Efterhånden som reaktionen skrider frem, nedbrydes kaliumnitrat. Det nedbrydes til kaliumoxid (K2O) og nitrogendioxid (NO2) gas.
3. Røggenerering:
- Den hurtige produktion af kuldioxid, vanddamp og nitrogendioxidgasser under reaktionen fører til dannelse af røg.
- Røgen består af bittesmå partikler af uforbrændt kulstof og andre reaktionsprodukter suspenderet i luften.
- Røgen er ofte ledsaget af en karakteristisk lugt på grund af tilstedeværelsen af nitrogendioxidgas.
Reaktionen mellem kaliumnitrat og sukker er meget eksoterm og frigiver store mængder varme og energi. Denne egenskab gør blandingen nyttig som drivmiddel i fyrværkeri, raketter og andre pyrotekniske enheder. Det er dog vigtigt at håndtere og bruge disse materialer med ekstrem forsigtighed på grund af deres potentiale for hurtig forbrænding og produktion af varme, ætsende gasser.
Sidste artikelHvad har B og Ge til fælles i det periodiske system?
Næste artikelHvad er 2 atomer, der har det samme antal protoner?
 Varme artikler
Varme artikler
-
 Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa
Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa -
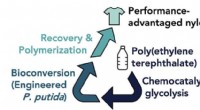 Forskere konstruerer mikroorganismer til at tackle PET-plastikforureningNREL- og ORNL-forskere har udviklet en metode til at opgradere PET til præstationsfordelagtig nylon, en forløber for andre værdifulde produkter såsom vandtæt tøj, stiftfri belægning af køkkengrej, og
Forskere konstruerer mikroorganismer til at tackle PET-plastikforureningNREL- og ORNL-forskere har udviklet en metode til at opgradere PET til præstationsfordelagtig nylon, en forløber for andre værdifulde produkter såsom vandtæt tøj, stiftfri belægning af køkkengrej, og -
 Mere bæredygtig genanvendelse af plastMobiltelefonetui lavet med 3D-print, ved brug af genbrugsplast. Kredit:Copyright:AG Mecking, Universitetet i Konstanz Plast er blandt de mest brugte materialer, og de er vitale komponenter i alle
Mere bæredygtig genanvendelse af plastMobiltelefonetui lavet med 3D-print, ved brug af genbrugsplast. Kredit:Copyright:AG Mecking, Universitetet i Konstanz Plast er blandt de mest brugte materialer, og de er vitale komponenter i alle -
 Genanvendelige stofmasker holder efter et års vask, tørringForskellige prøver, der blev brugt i denne undersøgelse, er vist fra øverst til højre til bund i urets retning:N95 respirator, KN95 åndedrætsværn, kirurgisk maske, vask/tør prøve kupon, 2-lags bandana
Genanvendelige stofmasker holder efter et års vask, tørringForskellige prøver, der blev brugt i denne undersøgelse, er vist fra øverst til højre til bund i urets retning:N95 respirator, KN95 åndedrætsværn, kirurgisk maske, vask/tør prøve kupon, 2-lags bandana
- Undersøgelse viser kvantehastigheden af overvåget maskinlæring på en ny klassificeringsopgave
- London-showet udforsker en skjult verden af ansigtsgenkendelse
- 1D-model hjælper med at tydeliggøre implosionsydeevne hos NIF
- En ny online-beregner estimerer den sande værdi af aktier hos venture-støttede startups
- Lemurer viser, at der ikke er nogen enkelt formel for varig kærlighed
- Hvad er øko-droner?


