Radius af et niobium atom har tæthed 8,57 og krystalliserer med den kropscentrerede kubiske enhedscelle?
$$V=a^3$$
Hvor 'a' er længden af kanten af terningen.
Rumfanget af et niobiumatom er:
$$V_{Nb}=(4/3)\pi r^3$$
Da der er to atomer pr. enhedscelle, er volumenet af to Niobium-atomer:
$$2V_{Nb}=(8/3)\pi r^3$$
Ved at sætte disse to volumener lig med hinanden får vi:
$$a^3=(8/3)\pi r^3$$
Løser vi for 'r' får vi:
$$r=\sqrt[3]{\frac{3a^3}{8\pi}}$$
Densiteten af Niobium er givet ved:
$$\rho=\frac{2M}{a^3N_A}$$
Hvor M er den molære masse af Niobium (92,91 g/mol), $N_A$ er Avogadros tal (6,022 x 10^23 atomer/mol), og 'a' er længden af terningens kant.
Løser vi for 'a' får vi:
$$a=\sqrt[3]{\frac{2M}{\rho N_A}}$$
Ved at erstatte dette udtryk med 'a' i ligningen for 'r' får vi:
$$r=\sqrt[3]{\frac{3(2M/\rho N_A)^3}{8\pi}}$$
Indsætter vi værdierne for M, $\rho$ og $N_A$, får vi:
$$r=\sqrt[3]{\frac{3(2\times92.91\text{g/mol}/8.57\text{g/cm}^3\times6.022\times10^{23}\text { atomer/mol})^3}{8\pi}}$$
$$r=1,43\times10^{-8}\text{ cm}$$
Derfor er radius af et niobium atom $$1,43\times10^{-8}\text{ cm}$$.
Sidste artikelHvad forekommer vand i luften som en usynlig gas?
Næste artikelEr natriumhypoklorit frit klor?
 Varme artikler
Varme artikler
-
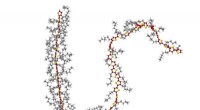 Forskere opdager en måde at kontrollere farven på OLED'erTil venstre, en polymer med en aflang rygrad (rød-gul). De lange sidekæder (grå) af de molekylære byggesten danner et stillads, der stabiliserer forlængelsen. Til højre, en polymer med en bøjet rygrad
Forskere opdager en måde at kontrollere farven på OLED'erTil venstre, en polymer med en aflang rygrad (rød-gul). De lange sidekæder (grå) af de molekylære byggesten danner et stillads, der stabiliserer forlængelsen. Til højre, en polymer med en bøjet rygrad -
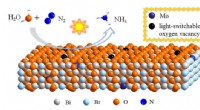 Forbedret omgivende ammoniakfotosyntese ved hjælp af nanosheets med lysomskiftelige iltpladserForskere har præsenteret en strategi ved samtidig at introducere lysomskiftelig ilt-ledighed og dopingmo i Bi 5 O 7 Br nanosheets til effektivt fotokatalytisk N 2 fiksering. Den modificerede fot
Forbedret omgivende ammoniakfotosyntese ved hjælp af nanosheets med lysomskiftelige iltpladserForskere har præsenteret en strategi ved samtidig at introducere lysomskiftelig ilt-ledighed og dopingmo i Bi 5 O 7 Br nanosheets til effektivt fotokatalytisk N 2 fiksering. Den modificerede fot -
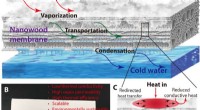 Ny træmembran giver et bæredygtigt alternativ til vandfiltreringSkematisk af processen med brug af den nye træmembran til destillering af vand. Kredit:T. Li, University of Maryland. Inspireret af det indviklede vandsystem, der cirkulerer i et træ, et team af f
Ny træmembran giver et bæredygtigt alternativ til vandfiltreringSkematisk af processen med brug af den nye træmembran til destillering af vand. Kredit:T. Li, University of Maryland. Inspireret af det indviklede vandsystem, der cirkulerer i et træ, et team af f -
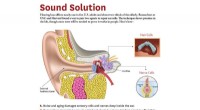 Tilslutning af hørehjælpemolekyler til øreknoglenKredit:USC Forskere ved USC og Harvard har udviklet en ny tilgang til at reparere celler dybt inde i øret - et potentielt middel, der kan genoprette hørelsen for millioner af ældre mennesker og an
Tilslutning af hørehjælpemolekyler til øreknoglenKredit:USC Forskere ved USC og Harvard har udviklet en ny tilgang til at reparere celler dybt inde i øret - et potentielt middel, der kan genoprette hørelsen for millioner af ældre mennesker og an
- Honningbier afslører miljøforurening i deres omgivelser
- Team hævder at have lavet en prøve af stanene
- Gammelt skallama-offer fundet i Titicaca-søen
- Norges domstol giver udsættelse til syv ulve
- Chemist udvikler en måde at producere nye materialer til solpaneler på
- NASA fanger kortvarig tropisk storm Amanda


