Hvorfor er en opløsning af aluminiumchlodie surere end natriumchlorid?
Surhedsgraden af en saltopløsning bestemmes af saltets evne til at hydrolysere vand. Hydrolyse er en kemisk reaktion, hvor vandmolekyler nedbrydes til hydrogenioner (H+) og hydroxidioner (OH-). I hvilket omfang et salt hydrolyserer vand afhænger af ladningstætheden af metalionen.
Metalioner med en højere ladningstæthed er mere tilbøjelige til at hydrolysere vand, fordi de tiltrækker elektroner stærkere end metalioner med en lavere ladningstæthed. Det betyder, at metalioner med en højere ladningstæthed er mere tilbøjelige til at donere en proton til vand, hvilket gør opløsningen mere sur.
Ved aluminiumchlorid og natriumchlorid har aluminiumionen en ladning på +3, mens natriumionen har en ladning på +1. Det betyder, at aluminiumionen har en højere ladningstæthed end natriumionen, hvilket gør den mere tilbøjelig til at hydrolysere vand og donere en proton til vand. Dette gør opløsningen af aluminiumchlorid mere sur end opløsningen af natriumchlorid.
Sidste artikelHvad er bituminøs brunkul og antracit?
Næste artikelEr vand syrebase eller salt?
 Varme artikler
Varme artikler
-
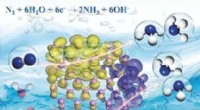 Ammoniaksyntese gennem elektroreduktion af nitrogen på sorte fosfor nanosheetsKredit:Wiley Mere end 100 år efter introduktionen af Haber -Bosch -processen, forskere fortsætter med at søge efter alternative ammoniakproduktionsruter, der er mindre energikrævende. Kinesiske
Ammoniaksyntese gennem elektroreduktion af nitrogen på sorte fosfor nanosheetsKredit:Wiley Mere end 100 år efter introduktionen af Haber -Bosch -processen, forskere fortsætter med at søge efter alternative ammoniakproduktionsruter, der er mindre energikrævende. Kinesiske -
 Kunstigt producerede celler kommunikerer med hinandenFørste forfatter Aurore Dupin og prof. Friedrich Simmel ved fluorescensmikroskopet. De bruger mikromanipulatorer til at samle deres kunstige cellesystemer. Kredit:Uli Benz / TUM Friedrich Simmel o
Kunstigt producerede celler kommunikerer med hinandenFørste forfatter Aurore Dupin og prof. Friedrich Simmel ved fluorescensmikroskopet. De bruger mikromanipulatorer til at samle deres kunstige cellesystemer. Kredit:Uli Benz / TUM Friedrich Simmel o -
 Forskere udvikler fuldt soldrevet autonomt kemisk minianlægDen solcelledrevne minireaktor. Kredit:Noël Research Group Professor Timothy Noël og kolleger i Flow Chemistry-gruppen ved Van t Hoff Instituttet for Molekylær Videnskab ved Universitetet i Amster
Forskere udvikler fuldt soldrevet autonomt kemisk minianlægDen solcelledrevne minireaktor. Kredit:Noël Research Group Professor Timothy Noël og kolleger i Flow Chemistry-gruppen ved Van t Hoff Instituttet for Molekylær Videnskab ved Universitetet i Amster -
 SmartFarm-enhed høster luftfugtighed for autonom, selvbærende bylandbrugKredit:National University of Singapore Et team af forskere fra National University of Singapore (NUS) har for nylig udviklet en simpel løsning til at løse to af verdens største problemer - vandkn
SmartFarm-enhed høster luftfugtighed for autonom, selvbærende bylandbrugKredit:National University of Singapore Et team af forskere fra National University of Singapore (NUS) har for nylig udviklet en simpel løsning til at løse to af verdens største problemer - vandkn
- Sagen om de manglende diamanter
- Svovl forbedrer dobbeltbrydningen til udvikling af flydende krystallinske molekyler
- Forskere skaber hurtigere, mere følsom fotodetektor ved at narre grafen
- Undersøgelse viser hidtil usete ændringer i verdens floder
- Hvad kan man forvente af det californiske benzindrevne bilforbud
- Tsunamisikker Golf er intet andet end, eksperter advarer


