Hvordan tilberedes fosfatbuffer pH 5,8?
For at fremstille *V* mL af en fosfatbuffer med *C"M af NaH2PO4 og *D*M af Na2HPO4, der producerer en pH-værdi på 5,8, skal du bruge følgende:
$$ [H^+] =10^{−5,8} =1,58 × 10^{−6} M$$
Hvor [H+] er den ønskede hydrogenionkoncentration.
Vi kan bruge Henderson-Hasselbalch-ligningen til at beregne forholdet mellem NaH2PO4 og Na2HPO4, der kræves for at opnå denne pH:
$$pH =pKa + log \venstre ( \frac{[A^-]}{[HA]} \right )$$
Hvor:
* *Ka* er syredissociationskonstanten for H2PO4- (den konjugerede syre af NaH2PO4)
* [A-] er koncentrationen af Na2HPO4 (den konjugerede base af NaH2PO4)
* [HA] er koncentrationen af NaH2PO4 (syreformen)
*Ka* for H2PO4- ved 25°C er *2,2 *10-7*. Derfor, ved at erstatte de givne værdier i Henderson-Hasselbalch-ligningen, får vi:
$$5,8 =7,2 + log \venstre ( \frac{[Na2HPO4]}{[NaH2PO4]} \right )$$
Ved at løse for [Na2HPO4] / [NaH2PO4], får vi:
$$\frac {[Na2HPO4]}{[NaH2PO4]} =0,398$$
Derfor bør forholdet mellem [NaH2PO4] og [Na2HPO4] være 1:0,398 for at opnå en pH på 5,8.
Trin 2:Forbered NaH2PO4- og Na2HPO4-opløsningerne
- Afvej den nødvendige mængde NaH2PO4 (0,2 M) og Na2HPO4 (0,1 M) ved hjælp af en analytisk vægt.
- Opløs hver forbindelse i Milli-Q-vand i separate beholdere.
- Fyld op på volumen af hver opløsning til 500 ml med Milli-Q-vand.
*Trin 3:Bland NaH2PO4- og Na2HPO4-opløsningerne
- Bland de to opløsninger i det passende forhold (i dette tilfælde 1 volumen af 0,2 M NaH2PO4-opløsningen til 0,398 volumen af 0,1 M Na2HPO4-opløsningen).
- Tilsæt DI-vand for at bringe det samlede volumen op på 1 liter.
- Tjek bufferens pH ved hjælp af et pH-meter. Om nødvendigt justeres pH ved at tilsætte små mængder af enten 0,2 M NaH2PO4- eller 0,1 M Na2HPO4-opløsningen.
 Varme artikler
Varme artikler
-
 Klarere og bedre fokuserede SEM-billederKredit:Pohang University of Science &Technology (POSTECH) Med begyndelsen af den 4. industrielle revolution, kunstig intelligens er for nylig blevet brugt i smartphone -kameraer, leverer funktio
Klarere og bedre fokuserede SEM-billederKredit:Pohang University of Science &Technology (POSTECH) Med begyndelsen af den 4. industrielle revolution, kunstig intelligens er for nylig blevet brugt i smartphone -kameraer, leverer funktio -
 Praktisk løsning til at forhindre korrosiv opbygning i nukleare systemerForskere har udtænkt en praktisk løsning til at forhindre ætsende ophobning i nukleare systemer. Billedet viser prøver af en standard reaktor zirconium legering med og uden vores CRUD-resistente belæg
Praktisk løsning til at forhindre korrosiv opbygning i nukleare systemerForskere har udtænkt en praktisk løsning til at forhindre ætsende ophobning i nukleare systemer. Billedet viser prøver af en standard reaktor zirconium legering med og uden vores CRUD-resistente belæg -
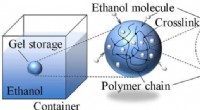 Forskere viser, hvordan man opbevarer flydende brændstoffer i polymere geler for at forhindre ekspl…Forskere fra SIT Japan viste i en ny undersøgelse, at kemisk tværbundne polymere gel-netværk kan fange meget flygtige flydende brændstofmolekyler, såsom ethanol, gennem fysiske interaktioner og derved
Forskere viser, hvordan man opbevarer flydende brændstoffer i polymere geler for at forhindre ekspl…Forskere fra SIT Japan viste i en ny undersøgelse, at kemisk tværbundne polymere gel-netværk kan fange meget flygtige flydende brændstofmolekyler, såsom ethanol, gennem fysiske interaktioner og derved -
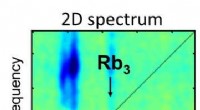 Forskere anvender 2-D spektroskopi til isolerede molekylære systemer for første gang2-D spektroskopi illustrerer de lysinducerede reaktioner af Rubidium molekyler i forskellige farvespektre. Illustration:Lukas Bruder Et forskerhold ledet af Prof. Dr. Frank Stienkemeier og Dr. Luk
Forskere anvender 2-D spektroskopi til isolerede molekylære systemer for første gang2-D spektroskopi illustrerer de lysinducerede reaktioner af Rubidium molekyler i forskellige farvespektre. Illustration:Lukas Bruder Et forskerhold ledet af Prof. Dr. Frank Stienkemeier og Dr. Luk
- Et 4,4 millioner år gammelt skelet kunne afsløre, hvor tidligt mennesker begyndte at gå oprejst
- Canadisk olieby ophæver ordrer om evakuering af naturbrande
- Hvordan NASA forbereder rumfartøjer til den hårde stråling fra rummet
- Hvordan omsorg for børn kan hjælpe Aboriginal Elders under lockdown
- Hvordan planter vokser og udvikler sig
- Hvorfor ændres antallet af protoner ikke for et enkelt element, mens neutroner og elektroner kan?


