Hvordan kunne du påvise tilstedeværelsen af Cl-ion?
1. Sølvnitrattest:
- Tilsæt et par dråber sølvnitrat (AgNO3) opløsning til prøven.
- Hvis der er Cl⁻-ioner til stede, dannes et hvidt bundfald af sølvchlorid (AgCl).
- Reaktionen kan repræsenteres som:
AgNO3 + NaCl → AgCl (hvidt bundfald) + NaNO3
2. Flammetest:
- Rengør en nichromtråd eller en platintråd ved at dyppe den i saltsyre (HCl) og derefter opvarme den i en flamme, indtil flammen bliver ikke-lysende.
- Dyp den rene tråd i prøven og hold den derefter i en bunsenbrænderflamme.
- Hvis der er Cl⁻-ioner til stede, bliver flammen gulgrøn.
3. Konduktivitetsmåling:
- Kloridioner er elektrisk ladede, så deres tilstedeværelse kan detekteres ved at måle opløsningens elektriske ledningsevne.
- Hvis opløsningens ledningsevne stiger ved tilsætning af en prøve sammenlignet med rent vand, indikerer det tilstedeværelsen af Cl⁻-ioner.
4. Spektrofotometeranalyse:
- Kloridioner kan absorbere ultraviolet (UV) lys ved bestemte bølgelængder.
- Ved at måle absorbansen af prøven ved passende bølgelængder ved hjælp af et spektrofotometer kan koncentrationen af Cl⁻-ioner bestemmes.
5. Kemiske test med andre reagenser:
- Forskellige reagenser kan reagere med Cl⁻-ioner og danne farvede produkter eller bundfald. For eksempel:
- Bariumchlorid (BaCl2) danner et hvidt bundfald af bariumchlorid (BaCl2).
- Blynitrat (Pb(NO3)2) danner et hvidt bundfald af blychlorid (PbCl2).
- Ferrichlorid (FeCl3) danner et brunfarvet kompleks med Cl⁻-ioner.
Det er vigtigt at bemærke, at selvom disse tests kan give en indikation af tilstedeværelsen af Cl⁻-ioner, kan yderligere kvalitative og kvantitative analyser være nødvendige for at bekræfte deres koncentration og fraværet af interfererende ioner.
Sidste artikelHvordan er faste stoffer, væske og gas arrangeret?
Næste artikelHvordan tilberedes fosfatbuffer pH 5,8?
 Varme artikler
Varme artikler
-
 At lave mere MXene:Forskere løfter sløret for et skalerbart produktionssystem til de lovende, 2-D …Efter næsten et årti med forskning, der viser, at MXene-materialer kan bruges til at forbedre en række teknologier, Drexel-forskere har nu en måde at fremstille materialet i store nok partier til at b
At lave mere MXene:Forskere løfter sløret for et skalerbart produktionssystem til de lovende, 2-D …Efter næsten et årti med forskning, der viser, at MXene-materialer kan bruges til at forbedre en række teknologier, Drexel-forskere har nu en måde at fremstille materialet i store nok partier til at b -
 At bryde grænsen for kemiske forbindelserKredit:CC0 Public Domain Siden slutningen af det 19. århundrede, overgangsmetalcarbonyler har været en vigtig og velkendt klasse af forbindelser inden for koordinationskemi og organometallisk ke
At bryde grænsen for kemiske forbindelserKredit:CC0 Public Domain Siden slutningen af det 19. århundrede, overgangsmetalcarbonyler har været en vigtig og velkendt klasse af forbindelser inden for koordinationskemi og organometallisk ke -
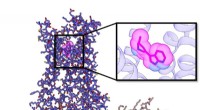 Forskere skaber ikke-psykedeliske forbindelser med samme antidepressive effektRepræsentation af serotonin 2A-receptoren (5HT2AR) signalerende proteinkompleks bundet til den nye forbindelse R-69 (i undergruppe, magenta). Kredit:Roth Lab, UNC School of Medicine Selvom det er u
Forskere skaber ikke-psykedeliske forbindelser med samme antidepressive effektRepræsentation af serotonin 2A-receptoren (5HT2AR) signalerende proteinkompleks bundet til den nye forbindelse R-69 (i undergruppe, magenta). Kredit:Roth Lab, UNC School of Medicine Selvom det er u -
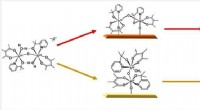 En ny katalysator til vandspaltning, der er det bedste fra begge verdenerKredit:American Chemical Society At tage vand og rive det fra hinanden til brint og ilt kan danne grundlaget for kunstige fotosyntetiske enheder, der i sidste ende kan drive hjem og virksomheder.
En ny katalysator til vandspaltning, der er det bedste fra begge verdenerKredit:American Chemical Society At tage vand og rive det fra hinanden til brint og ilt kan danne grundlaget for kunstige fotosyntetiske enheder, der i sidste ende kan drive hjem og virksomheder.
- Hvordan man fortæller forskellen mellem brandmyrer og regelmæssige myrer
- Elsker du din bil? Det kan være dyrt at blive for knyttet
- Hvad sker der, når lufttryk og temperatur falder?
- Sådan diagnostiseres et kredsløbskort med en dårlig transistor
- Hvad er pH-værdien af let af?
- Glem flyvende taxaer:Sådan vinder du offentlig støtte og får droner til at gavne byer


