Hvorfor har ikke-metaller et negativt oxidationstal?
Denne tendens til at få elektroner skyldes deres høje elektronegativitet, hvilket er et atoms evne til at tiltrække elektroner. Jo mere elektronegativt et atom er, jo stærkere dets træk på elektroner, og jo mere sandsynligt er det at få elektroner i en reaktion.
Når et ikke-metal får elektroner, får det en negativ ladning og siges at blive reduceret. Oxidationstallet for et ikke-metal falder, efterhånden som det får elektroner og bliver mere negativt.
For eksempel, i reaktionen mellem natrium (Na) og chlor (Cl) for at danne natriumchlorid (NaCl), får chlor en elektron fra natrium og bliver til en negativt ladet chloridion (Cl-). Oxidationstallet for chlor ændres fra 0 i elementært chlor til -1 i chloridionen.
Sammenfattende har ikke-metaller tendens til at have negative oxidationstal, fordi de får elektroner i kemiske reaktioner og bliver negativt ladede ioner. Dette skyldes deres høje elektronegativitet og tendensen til at gennemgå reduktion.
 Varme artikler
Varme artikler
-
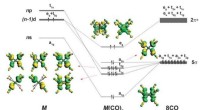 Kemikere viser, at 18-elektronprincippet ikke er begrænset til overgangsmetallerBindingsskema og form af de besatte valensorbitaler af M(CO) 8 (M =Ca, Sr, eller Ba). Opdeling af spd -valensorbitalerne i et atom M med konfigurationen (n - 1) d 2 ns 0 np 0 i oktakoordinatku
Kemikere viser, at 18-elektronprincippet ikke er begrænset til overgangsmetallerBindingsskema og form af de besatte valensorbitaler af M(CO) 8 (M =Ca, Sr, eller Ba). Opdeling af spd -valensorbitalerne i et atom M med konfigurationen (n - 1) d 2 ns 0 np 0 i oktakoordinatku -
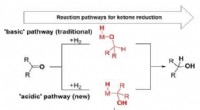 Metalhydrider med forbedret stabilitet i vandFigur viser de basiske og sure metalhydridveje for ketonreduktionsreaktionen. Alternative reaktionsveje for kendte reaktioner bidrager til forståelsen af katalytiske systemer, men giver også mulighe
Metalhydrider med forbedret stabilitet i vandFigur viser de basiske og sure metalhydridveje for ketonreduktionsreaktionen. Alternative reaktionsveje for kendte reaktioner bidrager til forståelsen af katalytiske systemer, men giver også mulighe -
 Video:Kemien bag sortkrudtKredit:The American Chemical Society Old-school krudt kaldes virkelig sort krudt, og det var så afgørende for den revolutionære krigsindsats, at de tidlige amerikanere gik meget (og groft) langt f
Video:Kemien bag sortkrudtKredit:The American Chemical Society Old-school krudt kaldes virkelig sort krudt, og det var så afgørende for den revolutionære krigsindsats, at de tidlige amerikanere gik meget (og groft) langt f -
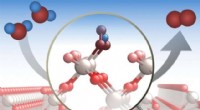 Undersøgelsen afslører detaljer om, hvordan en udbredt katalysator spalter vandIltudviklingsreaktioner er vigtige i en række industrielle processer. En ny undersøgelse giver en detaljeret analyse af processen på molekylært niveau. Som illustreret her, forskerne analyserede, hvor
Undersøgelsen afslører detaljer om, hvordan en udbredt katalysator spalter vandIltudviklingsreaktioner er vigtige i en række industrielle processer. En ny undersøgelse giver en detaljeret analyse af processen på molekylært niveau. Som illustreret her, forskerne analyserede, hvor
- Mærkelig opdagelse kan hjælpe med at forfine teorier om, hvordan planeter dannes
- Hvad er 3 slags lagringsmedier?
- Sådan konserveres planter og dyr
- Ny algoritme skærer gennem støjende data for bedre at forudsige vippepunkter
- Super Proton Synchrotron til at modtage en ny stråledump
- Hydraulisk oliedensitet


