Hvad er stærkest alkalisk kaustisk eller soda?
Styrken af en alkali bestemmes af dens evne til at donere hydroxidioner (OH-) i vand. Jo flere hydroxidioner en alkali kan donere, jo stærkere er den.
Kaustisk soda er en meget opløselig base, der dissocierer fuldstændigt i vand for at danne natriumioner (Na+) og hydroxidioner (OH-). Den har en pH på omkring 13, hvilket indikerer en høj koncentration af hydroxidioner.
På den anden side er soda et moderat opløseligt salt, der undergår delvis dissociation i vand. Det danner natriumioner (Na+) og carbonationer (CO32-). Carbonationerne kan reagere med vand og danne bicarbonationer (HCO3-) og hydroxidioner (OH-), men koncentrationen af hydroxidioner er lavere sammenlignet med kaustisk soda. pH-værdien af en mættet sodaopløsning er omkring 11.
Derfor betragtes kaustisk soda som en stærkere alkali end soda på grund af dens højere hydroxidionkoncentration og større evne til at hæve pH i en opløsning.
 Varme artikler
Varme artikler
-
 Organiseret kaos i enzymkomplekset – overraskende indsigt og nye perspektiverDe ti enzymatiske komponenter i AROM-komplekset på arbejde, katalyserer de kemiske reaktioner skitseret i baggrunden. Kredit:Max Planck Society For proteinmolekyler, der bidrager til stofskiftet,
Organiseret kaos i enzymkomplekset – overraskende indsigt og nye perspektiverDe ti enzymatiske komponenter i AROM-komplekset på arbejde, katalyserer de kemiske reaktioner skitseret i baggrunden. Kredit:Max Planck Society For proteinmolekyler, der bidrager til stofskiftet, -
 Undersøgelse viser, hvordan små rum kunne have været forud for cellerForskere brugte Argonnes Advanced Photon Source til at studere membranløse rum kaldet komplekse coacervater, da de gennemgik våd-tør-cykler, en undersøgelse, der kaster lys over den prebiotiske jord o
Undersøgelse viser, hvordan små rum kunne have været forud for cellerForskere brugte Argonnes Advanced Photon Source til at studere membranløse rum kaldet komplekse coacervater, da de gennemgik våd-tør-cykler, en undersøgelse, der kaster lys over den prebiotiske jord o -
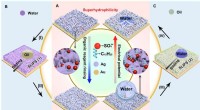 Elektrodeponerede overflader med reversibelt skiftende grænsefladeegenskaberReversibelt skiftende befugtningsevne og væskeafvisning af de elektroafsatte sølvporøse membraner. (A) Reversibel befugtningsovergang fra superhydrofil til superhydrofob, muliggjort af orienteringsænd
Elektrodeponerede overflader med reversibelt skiftende grænsefladeegenskaberReversibelt skiftende befugtningsevne og væskeafvisning af de elektroafsatte sølvporøse membraner. (A) Reversibel befugtningsovergang fra superhydrofil til superhydrofob, muliggjort af orienteringsænd -
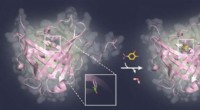 Blokering af sukkerstrukturer på vira og tumorcellerProf. Skerras aktuelle forskningsresultater baner vejen for udviklingen af nye typer bindingsproteiner til biologiske sukkerstrukturer, som spiller en væsentlig rolle ved kræft såvel som infektionss
Blokering af sukkerstrukturer på vira og tumorcellerProf. Skerras aktuelle forskningsresultater baner vejen for udviklingen af nye typer bindingsproteiner til biologiske sukkerstrukturer, som spiller en væsentlig rolle ved kræft såvel som infektionss
- Højtryk skaber nye naboer til beryllium
- Hvordan kunder søger efter hedoniske versus utilitaristiske køb
- I 600 år har Voynich-manuskriptet forblevet et mysterium - nu mener forskere, at det delvist handle…
- Er LiOH en ionisk eller kovalent forbindelse?
- Hvad oxytocin kan fortælle os om udviklingen af menneskelig prosocialitet
- Forbedring af neuronfabrikken - ny modulator af stamcelleidentitet fundet


