Hvilken type atomer vil typisk danne en ionbinding?
Atomer, der typisk danner ionbindinger omfatter:
1. Alkalimetaller (Gruppe 1):Disse grundstoffer har en lav elektronegativitet og mister let deres yderste elektron for at danne positive ioner (kationer). Eksempler omfatter lithium (Li), natrium (Na) og kalium (K).
2. Jordalkalimetaller (Gruppe 2):I lighed med alkalimetaller har jordalkalimetaller en lav elektronegativitet og mister let deres to yderste elektroner for at danne positive ioner. Eksempler omfatter calcium (Ca), magnesium (Mg) og strontium (Sr).
3. Halogener (Gruppe 17):Halogener har en høj elektronegativitet og tiltrækker kraftigt elektroner fra andre atomer. De får let en elektron for at opnå en stabil elektronkonfiguration og danner negative ioner (anioner). Eksempler omfatter fluor (F), chlor (Cl) og brom (Br).
4. Ilt og svovl (Gruppe 16):Ilt og svovl har en høj elektronegativitet og kan danne negative ioner ved at få elektroner fra mere elektropositive grundstoffer. De danner ofte ionbindinger med metaller.
Generelt opstår ionbindinger, når der er en stor elektronegativitetsforskel mellem et metal og et ikke-metal. Metallet mister elektroner til ikke-metallet, hvilket resulterer i dannelsen af positivt ladede metalioner og negativt ladede ikke-metalioner. Disse modsat ladede ioner holdes derefter sammen af elektrostatiske kræfter for at danne en ionisk forbindelse.
Sidste artikelHvor mange elektroner kan klor donere?
Næste artikelHvad er Ba OH 2 individuelle ioner?
 Varme artikler
Varme artikler
-
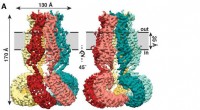 Hvordan en manetformet struktur lindrer trykket i dine cellerDen nye undersøgelse, offentliggjort for nylig i tidsskriftet eLife , viser, at SWELL1 er lavet af seks underenheder, der mødes på toppen, bundter sammen for at danne en manetlignende kappe med seks
Hvordan en manetformet struktur lindrer trykket i dine cellerDen nye undersøgelse, offentliggjort for nylig i tidsskriftet eLife , viser, at SWELL1 er lavet af seks underenheder, der mødes på toppen, bundter sammen for at danne en manetlignende kappe med seks -
 Farmakoskopi muliggør opdagelse af immunmodulerende lægemidler ved at analysere immuncelleinterakt…Gregory Vladimer, Nikolaus Krall, Berend Snijder og Giulio Superti-Furga (fra venstre mod højre) er ved siden af Pharmacoscopy high-throughput mikroskop. Kredit:Wolfgang Däuble/CeMM Immunsysteme
Farmakoskopi muliggør opdagelse af immunmodulerende lægemidler ved at analysere immuncelleinterakt…Gregory Vladimer, Nikolaus Krall, Berend Snijder og Giulio Superti-Furga (fra venstre mod højre) er ved siden af Pharmacoscopy high-throughput mikroskop. Kredit:Wolfgang Däuble/CeMM Immunsysteme -
 Tweaks bag genfødslen af næsten kasserede organiske solteknologierUdvælgelse af solceller i laboratoriet hos GTRI Principal Research Engineer Jud Ready. Cellerne inkluderer 3D, CZTS, organisk solcelle, og silicium. Kredit:Georgia Tech/Branden Camp Et solenergima
Tweaks bag genfødslen af næsten kasserede organiske solteknologierUdvælgelse af solceller i laboratoriet hos GTRI Principal Research Engineer Jud Ready. Cellerne inkluderer 3D, CZTS, organisk solcelle, og silicium. Kredit:Georgia Tech/Branden Camp Et solenergima -
 Ny tilgang forudsiger glas altid udviklende adfærd ved forskellige temperaturerMultiskala modellering af et polymerglas for at forudsige dets temperaturafhængige egenskaber. Kredit:Wenjie Xia/NIST Ikke alt ved glas er klart. Hvordan dets atomer er arrangeret og opfører sig,
Ny tilgang forudsiger glas altid udviklende adfærd ved forskellige temperaturerMultiskala modellering af et polymerglas for at forudsige dets temperaturafhængige egenskaber. Kredit:Wenjie Xia/NIST Ikke alt ved glas er klart. Hvordan dets atomer er arrangeret og opfører sig,
- Termonukleære røntgenudbrud og fald detekteret fra den binære røntgenstråle 4U 1323-62
- Hvad er en Hi-Shear Fastgøring?
- Sådan fungerer hydrauliske kraner
- Søg efter skyrmion fænomen finder endnu mærkeligere magnetisk perlehalskæde
- De fleste ioniske forbindelser består af en?
- Nyttigt eller uhyggeligt? Maskiner foreslår Gmail-svar


