Hvilken er den stærkeste base, hvad natriumhydroxid eller kaliumhydroxid?
Styrken af en base måles almindeligvis ved dens evne til at donere hydroxidioner (OH-) i en vandopløsning. Jo højere koncentrationen af hydroxidioner er, jo stærkere er basen.
I tilfælde af KOH og NaOH er begge metalhydroxider, der let dissocieres i vand. KOH dissocierer dog mere fuldstændigt end NaOH og frigiver en højere koncentration af hydroxidioner. Det betyder, at KOH har en højere pH-værdi og kan neutralisere mere syre pr. mol sammenlignet med NaOH.
Forskellen i styrke kan tilskrives flere faktorer. Kaliumioner (K+) er mindre end natriumioner (Na+), hvilket gør det muligt for KOH at have et mere kompakt og stabilt krystalgitter. Dette resulterer i en lavere gitterenergi for KOH sammenlignet med NaOH, hvilket gør det lettere for KOH at bryde fra hinanden og frigive hydroxidioner i vand.
Derudover er kaliumioner stærkere hydreret end natriumioner. Hydration refererer til tiltrækningen og interaktionen mellem ioner og vandmolekyler. Den stærkere hydrering af kaliumioner stabiliserer kaliumhydroxidopløsningen, hvilket yderligere fremmer dissociationen af KOH og frigivelsen af hydroxidioner.
Som et resultat af disse faktorer betragtes kaliumhydroxid (KOH) generelt som en stærkere base end natriumhydroxid (NaOH).
Sidste artikelHvad er det nuværende begreb om atom?
Næste artikelEr ammoniak eller hydroxid en stærkere syre?
 Varme artikler
Varme artikler
-
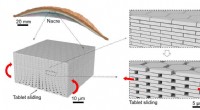 Ny type glas inspireret af naturen er mere modstandsdygtig over for stødMikroarkitekturen af Nacre og tablet, der glider i Nacre. Kredit:Z. Yin, F. Hannard, F. Barthelat Ved at bruge den iriserende perlemor, der ofte findes foring af muslingeskaller, forskere har ko
Ny type glas inspireret af naturen er mere modstandsdygtig over for stødMikroarkitekturen af Nacre og tablet, der glider i Nacre. Kredit:Z. Yin, F. Hannard, F. Barthelat Ved at bruge den iriserende perlemor, der ofte findes foring af muslingeskaller, forskere har ko -
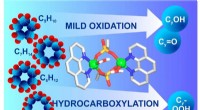 Kemikere udvikler en katalysator til at oxidere alkaner under milde forholdKredit:Natalia Deryugina RUDN-kemikere udviklede en katalysator til at oxidere alkaner uden yderligere opvarmning og under regelmæssigt tryk. Dette vil forenkle processen med at opnå alkoholer, sy
Kemikere udvikler en katalysator til at oxidere alkaner under milde forholdKredit:Natalia Deryugina RUDN-kemikere udviklede en katalysator til at oxidere alkaner uden yderligere opvarmning og under regelmæssigt tryk. Dette vil forenkle processen med at opnå alkoholer, sy -
 Bedre kemi gennem bittesmå antennerKredit:CC0 Public Domain Et forskerhold ved University of Tokyo har introduceret en kraftfuld metode til aktivt at bryde kemiske bindinger ved hjælp af excitationer i bittesmå antenner skabt af in
Bedre kemi gennem bittesmå antennerKredit:CC0 Public Domain Et forskerhold ved University of Tokyo har introduceret en kraftfuld metode til aktivt at bryde kemiske bindinger ved hjælp af excitationer i bittesmå antenner skabt af in -
 At fange atomer i aktion:se næste generations materialer krystallisereEn af de mange mulige ruter til næste generations materialer-dem, der muliggør nye fremskridt inden for datalagring, elektroniske anordninger, og lettere og stærkere strukturelle byggematerialer - er
At fange atomer i aktion:se næste generations materialer krystallisereEn af de mange mulige ruter til næste generations materialer-dem, der muliggør nye fremskridt inden for datalagring, elektroniske anordninger, og lettere og stærkere strukturelle byggematerialer - er
- Klimaregionerstyper
- Hvordan man maksimerer potentialet i markedsføringsfleksibilitet
- Hvad er en Whale Fluke?
- Tørveregistreringer hjælper med at afsløre det regionale mønster af holocæn temperaturændring …
- Bekæmpelse af luftforurening med naturen
- Termitter? tarmreaktioner viser, hvordan man kan forbedre vedvarende brændstof, siger forskere


