Hvad er det nuværende begreb om atom?
I den moderne opfattelse består et atom af en lille kerne, som indeholder positivt ladede protoner og neutrale neutroner, omgivet af et meget større rumfang indeholdende negativt ladede elektroner.
Her er en oversigt over det nuværende koncept for et atom:
1. Kerne:
Kernen er den centrale og mest massive del af et atom. Den indeholder protoner og neutroner. Protoner bærer en positiv elektrisk ladning, mens neutroner er elektrisk neutrale. Antallet af protoner i kernen definerer et grundstofs atomnummer og bestemmer dets kemiske egenskaber.
2. Electron Cloud:
Omkring kernen er elektronskyen, hvor elektronerne er placeret. Elektroner bærer en negativ elektrisk ladning, der balancerer den positive ladning af protonerne i kernen, hvilket gør atomet elektrisk neutralt generelt. Elektroner er arrangeret i skaller eller energiniveauer omkring kernen.
3. Energiniveauer og orbitaler:
Elektroner optager forskellige energiniveauer baseret på deres energi. Hvert energiniveau består af en eller flere underskaller, som er yderligere opdelt i orbitaler. Orbitaler er tredimensionelle områder omkring kernen, hvor der er størst sandsynlighed for, at elektroner findes.
4. Elektronkonfiguration:
Elektronkonfigurationen af et atom beskriver arrangementet af elektroner i forskellige orbitaler inden for energiniveauer. Det spiller en afgørende rolle i at bestemme atomets kemiske adfærd, da elektroner i det yderste energiniveau (valenselektroner) er involveret i kemisk binding.
5. Atomnummer:
Et grundstofs atomnummer er lig med antallet af protoner i dets kerne. Det identificerer grundstoffet og dets position i det periodiske system. Grundstoffer er arrangeret i stigende atomnummer fra venstre mod højre og top til bund.
6. Massenummer:
Massetallet for et atom er det samlede antal protoner og neutroner i dets kerne. Det er et mål for atomets masse og er givet ved summen af protontal og neutrontal.
7. Isotoper:
Atomer af samme grundstof kan have forskelligt antal neutroner, hvilket resulterer i forskellige isotoper. Isotoper har samme atomnummer, men varierer i massetal. De deler lignende kemiske egenskaber, men kan have forskellige fysiske egenskaber.
8. Elektronskaller:
Elektronskyen er organiseret i koncentriske elektronskaller, nummereret 1, 2, 3 og så videre, og bevæger sig væk fra kernen. Hver skal kan indeholde et bestemt antal elektroner baseret på dens energiniveau.
9. Kvantemekanik:
Den nuværende forståelse af atomare struktur og egenskaber er baseret på kvantemekanik, som giver en matematisk ramme til at beskrive adfærden af subatomære partikler såsom elektroner.
10. Bølge-partikeldualitet:
Kvantemekanik introducerer elektronernes bølge-partikeldualitet. Elektroner udviser egenskaber for både partikler (med masse og ladning) og bølger (med tilhørende bølgefunktioner).
Sammenfattende skildrer det moderne koncept for et atom en lille, tæt kerne indeholdende protoner og neutroner omgivet af en større elektronsky organiseret i energiniveauer og orbitaler. Denne forståelse af atomstruktur danner grundlaget for at forklare kemisk binding, grundstoffers egenskaber og stoffets opførsel.
Sidste artikelHvorfor diffunderer brintgas hurtigst?
Næste artikelHvilken er den stærkeste base, hvad natriumhydroxid eller kaliumhydroxid?
 Varme artikler
Varme artikler
-
 Nye strukturelle detaljer om det specifikke arrangement af atomer i konjugerede polymererKredit:Journal of the American Chemical Society cover Avancerede røntgenteknikker har afsløret nye strukturelle detaljer om det specifikke arrangement af atomer i konjugerede polymerer, en vigtig
Nye strukturelle detaljer om det specifikke arrangement af atomer i konjugerede polymererKredit:Journal of the American Chemical Society cover Avancerede røntgenteknikker har afsløret nye strukturelle detaljer om det specifikke arrangement af atomer i konjugerede polymerer, en vigtig -
 For at opsnuse kriminalitet og forsvundne personer, videnskaben støtter bloddetektionshundeHunde kan pålideligt opsnuse menneskeblod, selv efter to års miljøforringelse. Kredit:Jason Korbol/shutterstock Det er svært at overveje tragedien ved at miste en elsket en og aldrig vide, hvad de
For at opsnuse kriminalitet og forsvundne personer, videnskaben støtter bloddetektionshundeHunde kan pålideligt opsnuse menneskeblod, selv efter to års miljøforringelse. Kredit:Jason Korbol/shutterstock Det er svært at overveje tragedien ved at miste en elsket en og aldrig vide, hvad de -
 Overvågning af COVID-19:Kan medicin fundet i spildevand give en tidlig advarsel?For at studere medicin i spildevand bruger UB-forskere det udstyr og de teknikker, der er vist her, til at isolere kemiske forbindelser fra vandprøver. Kredit:Meredith Forrest Kulwicki / University at
Overvågning af COVID-19:Kan medicin fundet i spildevand give en tidlig advarsel?For at studere medicin i spildevand bruger UB-forskere det udstyr og de teknikker, der er vist her, til at isolere kemiske forbindelser fra vandprøver. Kredit:Meredith Forrest Kulwicki / University at -
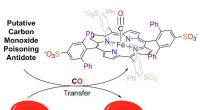 Lås op for en kur mod kulilteforgiftningEn voluminøs, vandopløselig jern-porphyrinforbindelse er blevet fremstillet, som binder CO, sekvestrerer CO fra COHb og redder CO-forgiftede røde blodlegemer. Som sådan kan det tjene som grundlag for
Lås op for en kur mod kulilteforgiftningEn voluminøs, vandopløselig jern-porphyrinforbindelse er blevet fremstillet, som binder CO, sekvestrerer CO fra COHb og redder CO-forgiftede røde blodlegemer. Som sådan kan det tjene som grundlag for
- Forskel mellem forbrugere på 1., 2. og 3. niveau i en madweb
- Efterligner hjernefunktioner med grafen-diamant-forbindelser
- Bare klimaændringshandling:Centrering af indfødt visdom og perspektiver
- Dokumenter viser, at Volkswagen modsatte sig tilbagekaldelse af Takata-airbag
- Forskergruppen vender kontakten til ferroelektrisk
- Vores Mars-rovermission blev suspenderet på grund af Ukraine-krigen. Hvad håbede på næste


