Hvorfor diffunderer brintgas hurtigst?
Brintgas har en molær masse på 2 g/mol, hvilket er den letteste af alle gasser. Derfor vil brintgas diffundere hurtigst.
Her er en matematisk forklaring på Grahams lov om effusion:
$$Rate \ af \ effusion \ \propto \ \frac{1}{\sqrt{Molar \ masse}}$$
hvor:
* Udstrømningshastighed er mængden af gas, der strømmer ud gennem en lille åbning i en tidsenhed.
* Molær masse er massen af et mol gas.
For to gasser A og B kan Grahams lov udtrykkes som følger:
$$\frac{Hastighed \ af \ effusion \ af \ A}{Rate \ af \ effusion \ af \ B} =\sqrt{\frac{Molar \ masse \ af \ B}{Molar \ masse \ af \ A} }$$
Hvis vi lader gas A være brintgas (H2) og gas B være en anden gas med molmassen M, så bliver ligningen:
$$\frac{Hastighed \ af \ effusion \ af \ H2}{Hastighed \ af \ effusion \ af \ gas \ B} =\sqrt{\frac{M}{2}}$$
Da den molære masse af brintgas er 2 g/mol, vil hastigheden for udstrømning af brintgas være:
$$ Rate \ af \ effusion \ af \ H2 =\sqrt{\frac{M}{2}} \ gange Rate \ af \ effusion \ af \ gas \ B$$
Fordi den molære masse af brintgas er den letteste af alle gasser, vil hastigheden af udstrømning af brintgas være den hurtigste af alle gasser.
Sidste artikelHvad er en kovalent netværksbinding?
Næste artikelHvad er det nuværende begreb om atom?
 Varme artikler
Varme artikler
-
 Ny software bringer cryo-EM-kort i lavere opløsning i fokusEt eksempel på den sekundære strukturdetektering i cryo-EM-densitetskort ved hjælp af Emap2Sec. Til venstre er et EM-kort over archaeal 20S proteasom (EMDB ID:EMD-1733). Til højre er detekteret sekund
Ny software bringer cryo-EM-kort i lavere opløsning i fokusEt eksempel på den sekundære strukturdetektering i cryo-EM-densitetskort ved hjælp af Emap2Sec. Til venstre er et EM-kort over archaeal 20S proteasom (EMDB ID:EMD-1733). Til højre er detekteret sekund -
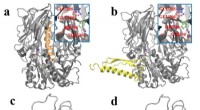 Nye glukagonlignende peptid-1-lægemidler designet til type 2-diabetesMolekylær docking mellem GLP-1-analoger og GLP-1-receptor og DPP-4. Kredit:Wang Peng Nye glukagon-lignende peptid-1 (GLP-1) lægemidler blev designet og industrielt fremstillet af forskere ved Hefei
Nye glukagonlignende peptid-1-lægemidler designet til type 2-diabetesMolekylær docking mellem GLP-1-analoger og GLP-1-receptor og DPP-4. Kredit:Wang Peng Nye glukagon-lignende peptid-1 (GLP-1) lægemidler blev designet og industrielt fremstillet af forskere ved Hefei -
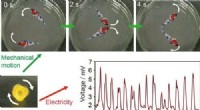 Vinben og minibotmotorerKredit:American Chemical Society Som enhver vinentusiast ved, benene, der løber ned ad et glas efter en blid hvirvel af vino, kan give spor om alkoholindhold. Interessant nok, det fysiske fænomen,
Vinben og minibotmotorerKredit:American Chemical Society Som enhver vinentusiast ved, benene, der løber ned ad et glas efter en blid hvirvel af vino, kan give spor om alkoholindhold. Interessant nok, det fysiske fænomen, -
 Ny katalysator gør styrenfremstilling billigere, grønnereKredit:North Carolina State University Kemiingeniørforskere har udviklet en ny katalysator, der markant øger udbyttet i styrenfremstilling, samtidig med at energiforbruget og drivhusgasemissionern
Ny katalysator gør styrenfremstilling billigere, grønnereKredit:North Carolina State University Kemiingeniørforskere har udviklet en ny katalysator, der markant øger udbyttet i styrenfremstilling, samtidig med at energiforbruget og drivhusgasemissionern
- Kemiske processer i retsmedicin
- Pesticidhåndtering svigter de australske vandveje og Great Barrier Reef
- Ny super-opløsning sonde fanger celler i hidtil usete detaljer
- Vand kan forsvinde fra Mars hurtigere end forventet
- Hvilket værktøj skal man bruge måle et salt?
- Styrkelse af citronfrugt for bedre at modstå klimaændringer


