Hvad er en kovalent netværksbinding?
Nøglekarakteristika for kovalente netværksbindinger:
1. Elektron Delokalisering:I en netværks kovalent binding er elektronerne ikke begrænset til et specifikt par atomer, men er i stedet delokaliseret over hele netværket. Denne delokalisering resulterer i et "hav" af elektroner, der deles mellem atomerne.
2.Stærke og stive strukturer:Den omfattende deling af elektroner i netværkets kovalente bindinger fører til dannelsen af meget stærke og stive strukturer. Bindingerne mellem atomerne er meget retningsbestemte og danner et tæt forbundet netværk, hvilket gør det svært at bryde eller deformere.
3. Høje smelte- og kogepunkter:Stoffer med kovalente netværksbindinger udviser typisk høje smelte- og kogepunkter. Dette skyldes, at der kræves en betydelig mængde energi for at overvinde de stærke interatomiske bindinger og bryde netværket.
4.Elektriske egenskaber:Netværks kovalente faste stoffer er generelt dårlige ledere af elektricitet. De delokaliserede elektroner er ikke frie til at bevæge sig og føre elektrisk strøm, hvilket resulterer i en høj elektrisk resistivitet.
Eksempler på stoffer med kovalente netværksbindinger omfatter:
1.Diamant:Hvert kulstofatom i diamant danner kovalente bindinger med fire andre kulstofatomer, hvilket skaber et stift og stærkt tredimensionelt netværk. Denne struktur er ansvarlig for diamantens ekstreme hårdhed og gør den til det hårdeste naturligt forekommende stof på Jorden.
2.Grafit:Kulstofatomer i grafit danner et hexagonalt netværk af kovalente bindinger. Men i modsætning til diamant er disse lag stablet løst, hvilket giver mulighed for svage interaktioner mellem dem. Denne struktur giver grafit sine bløde og glatte egenskaber og gør det til et fremragende materiale til blyanter og smøremidler.
3.Kvarts:Består primært af silicium og oxygenatomer, kvarts udviser en netværkskovalent struktur, hvor hvert siliciumatom binder sig til fire oxygenatomer og omvendt. Dette netværk resulterer i dannelsen af et hårdt og holdbart mineral, der findes i forskellige geologiske formationer.
Sammenfattende involverer kovalente netværksbindinger deling af elektroner mellem flere atomer, hvilket skaber et kontinuerligt netværk, der giver anledning til stærke og stive strukturer. Denne type binding er udbredt i faste stoffer og er ansvarlig for deres karakteristiske egenskaber, såsom høje smeltepunkter, lav elektrisk ledningsevne og enestående hårdhed.
Sidste artikelHvem opfandt den voltaiske celle?
Næste artikelHvorfor diffunderer brintgas hurtigst?
 Varme artikler
Varme artikler
-
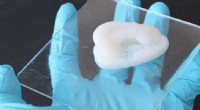 Udskrivning af komplekse cellulosebaserede objekterEn 3D-trykt ørebruskimitation lavet af cellulosekompositmaterialet. Kredit:Michael Hausmann / ETH Zürich / Empa Forskere fra ETH Zürich og de schweiziske føderale laboratorier for materialevidensk
Udskrivning af komplekse cellulosebaserede objekterEn 3D-trykt ørebruskimitation lavet af cellulosekompositmaterialet. Kredit:Michael Hausmann / ETH Zürich / Empa Forskere fra ETH Zürich og de schweiziske føderale laboratorier for materialevidensk -
 Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator
Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator -
 Nye beviser viser, at de første byggesten i livet på Jorden kan have været mere rodet end tidlige…Szostak mener, at de tidligste celler er udviklet på land i damme eller bassiner, potentielt i vulkansk aktive regioner. Ultraviolet lys, lynnedslag, og vulkanudbrud kunne alle have været med til at u
Nye beviser viser, at de første byggesten i livet på Jorden kan have været mere rodet end tidlige…Szostak mener, at de tidligste celler er udviklet på land i damme eller bassiner, potentielt i vulkansk aktive regioner. Ultraviolet lys, lynnedslag, og vulkanudbrud kunne alle have været med til at u -
 3D-udskrivning af den første biomimetiske tungeoverflade nogensindeDen 3D -printede negative form viser huller til filiforme og fungiforme papiller. Kredit:University of Leeds Forskere har skabt syntetiske bløde overflader med tungelignende teksturer for første g
3D-udskrivning af den første biomimetiske tungeoverflade nogensindeDen 3D -printede negative form viser huller til filiforme og fungiforme papiller. Kredit:University of Leeds Forskere har skabt syntetiske bløde overflader med tungelignende teksturer for første g
- Proteiner i hajtænder kunne antyde, hvad de spiser
- Sådan beregnes runde
- Interessante emner i kemi
- Astronomer er ikke glade for en russisk plan om at placere reklametavler i rummet
- Astronomer fanger sjældne billeder af planetdannende skiver omkring stjerner
- Stephen Hawkings Last Paper Takes on the Multiverse


