Ny super-opløsning sonde fanger celler i hidtil usete detaljer
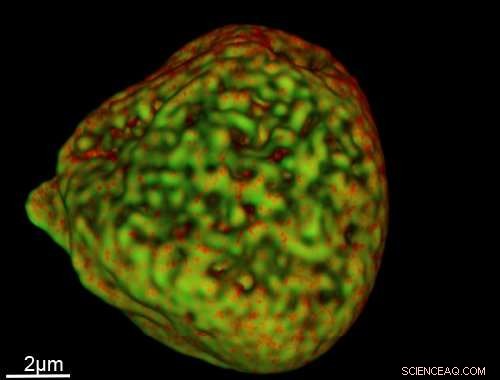
Et billede af en cellekerne optaget ved hjælp af den nye sonde. Kredit:University of Sheffield
Forskere har udviklet en ny teknik til at fange billeder af cellekernen med hidtil usete detaljer, baner vejen for ny indsigt i menneskelig sygdom og aldring.
Ved at bruge en ny selvlysende sonde til at oplyse cellekomponenter, forskere fra Department of Chemistry ved University of Sheffield har taget slående 3D-billeder af DNA i kerner i skalaer under 40 nanometer (én nanometer =en milliardtedel af en meter).
Sondens unikke egenskaber gør den bedre egnet til brug i superopløselig mikroskopi end eksisterende sonder, som ikke er stabile nok til at blive udsat for lange perioder med bestråling under intenst lys, som denne gren af mikroskopi kræver.
Sree Sreedharan, en ph.d.-studerende ved Institut for Kemi, udviklet sonden baseret på kemikaliet Ruthenium, i samarbejde med Rutherford Appleton Laboratory i Oxford og forskere i Sheffields afdelinger for biomedicinsk videnskab, og fysik og astronomi.
Hans vejleder, Professor Jim Thomas sagde:"Da sonden er stabil som en sten - selv i det mest intense laserlys - kan vi tage mange lag billeder for at konstruere endelige, meget detaljeret, 3D-strukturer, der viser DNA lagt ud i kernen.
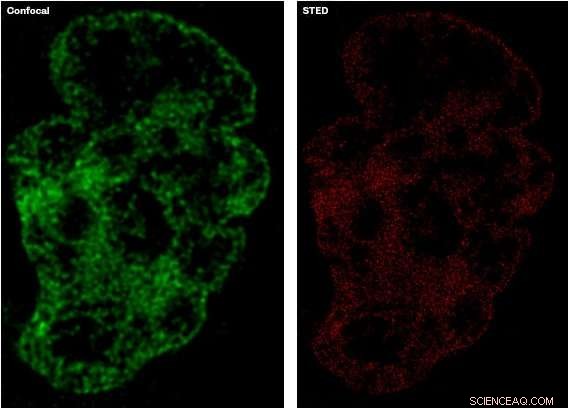
Billedet til venstre, i grøn, viser detaljeniveauet, der er fanget ved hjælp af etablerede konfokale mikroskopiteknikker, sammenlignet med billedet til højre, i rødt, som viser et mere detaljeret billede taget med STED-mikroskopi. Kredit:University of Sheffield
"Da DNA giver tegningerne for livet, super-opløsningsundersøgelser vil hjælpe med at forstå, hvordan det opbevares, Læs, og bearbejdet. Sådanne undersøgelser vil give ny indsigt i udviklingen af sygdomme som kræft og måske endda de cellulære processer involveret i aldring."
Ved at undersøge, hvordan sunde celler fungerer, og hvad der sker, når de ikke fungerer, forskere kan nå en dybere forståelse af, hvordan livet fungerer på dets mest grundlæggende niveau, og udvikle nye lægemidler og behandlinger mod sygdomme.
Imidlertid, celler er mikroskopiske, gennemsigtig, og oftest farveløs. For at se dem gennem mikroskoper, forskere bruger selvlysende prober, der binder til og "lyser op" cellekomponenter. Selvom denne tilgang massivt har fremmet vores forståelse af cellefunktion, træk mindre end omkring 300 nanometer kan ikke skelnes med normale lysbaserede mikroskoper.
Superopløsningsmikroskoper er blevet udviklet i det sidste årti, der kan, under de rette omstændigheder, opererer i meget mindre skalaer. Erik Betzig, Stefan W. Hell og William E. Moerner modtog Nobelprisen i kemi i 2014 for deres arbejde på dette område.
Udfordringen for kemikere er at udvikle nye sonder med optiske egenskaber, der opfylder de krav, som disse avancerede teknikker stiller til dem – f.eks. STED (stimulated emission depletion) mikroskopi kræver prober, der er usædvanligt fotokemisk stabile.
Den nye Ruthenium-baserede sonde blev udviklet til brug i scanning transmission elektronmikroskopi (STEM), og resultaterne er blevet offentliggjort online i Journal of the American Chemical Society . Forskningen blev afsluttet som en del af University of Sheffields Imagine:Imaging Life-projekt, som bruger revolutionerende mikroskopiteknikker til at besvare nogle af de største spørgsmål inden for biologi og medicin.
Sidste artikelFormskiftende middel er rettet mod skadelige bakterier i maven
Næste artikelForskere rapporterer om en ny kaskade -reaktion
 Varme artikler
Varme artikler
-
 Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el
Gør en-krystal diamant klar til elektronikForm af mosaik-enkeltkrystal diamantsubstrat før og efter plasma-assisteret polering. Kredit:Osaka University Silicium har været elektronikkens arbejdshest i årtier, fordi det er et almindeligt el -
 Farvede broderitråde efter behov sparer tid, penge og miljøKredit:Coloreel Det svenske firma Coloreel annoncerer partnerskab med Ricoh, den japanske teknologigigant, at revolutionere tekstilindustrien. Partnerskabet vil lancere en EU-støttet innovation, s
Farvede broderitråde efter behov sparer tid, penge og miljøKredit:Coloreel Det svenske firma Coloreel annoncerer partnerskab med Ricoh, den japanske teknologigigant, at revolutionere tekstilindustrien. Partnerskabet vil lancere en EU-støttet innovation, s -
 Video:Forårsager sukker diabetes?Kredit:The American Chemical Society I USA, diabetes er meget almindelig - 1 ud af 10 personer har det, og titusindvis af mennesker dør af det hvert år. Hvis du har diabetes, du har alt for meget
Video:Forårsager sukker diabetes?Kredit:The American Chemical Society I USA, diabetes er meget almindelig - 1 ud af 10 personer har det, og titusindvis af mennesker dør af det hvert år. Hvis du har diabetes, du har alt for meget -
 Sådan beregnes Joules of HeatTilbage i begyndelsen af det 19. århundrede demonstrerede en britisk bryggeri og fysiker ved navn James Joule, at varme og mekanisk arbejde var to former for den samme ting: energi. Hans opdagelse g
Sådan beregnes Joules of HeatTilbage i begyndelsen af det 19. århundrede demonstrerede en britisk bryggeri og fysiker ved navn James Joule, at varme og mekanisk arbejde var to former for den samme ting: energi. Hans opdagelse g
- Hjemmeunderviste børn er langt mere socialt engagerede, end du måske tror
- Næsten 90 % af astronauterne har været mænd. Men rummets fremtid kan være kvindelig
- Sådan gør du matematik sjov til børn
- Hvordan livet kunne hjælpe atmosfæriske tidevand med at bremse planetenes rotation
- Sådan beregnes arealet af en base
- Kemoterapimediciner reagerer forskelligt på stråling, mens de er i vand


