Hvilke to reaktioner er også redoxreaktioner?
$$2Ag_2O_{(s)} \rightarrow 4Ag_{(s)} +O_{2(g)}$$
I denne reaktion nedbrydes sølvoxid til sølvmetal og oxygengas. Sølv gennemgår en reduktion fra en oxidationstilstand på +1 i Ag2O til 0 i Ag, mens oxygen gennemgår en oxidation fra en oxidationstilstand på -2 i Ag2O til 0 i O2.
2. Reaktion af kobber og salpetersyre:
$$Cu_{(s)} + 4HNO_{3(aq)} \rightarrow Cu(NO_3)_{2(aq)} + 2NO_{2(g)}+ 2H_2O_{(l)}$$
I denne reaktion reagerer kobbermetal med salpetersyre for at danne kobbernitrat, nitrogendioxidgas og vand. Kobber gennemgår en oxidation fra en oxidationstilstand på 0 i Cu til +2 i Cu(NO3)2, mens nitrogen gennemgår en reduktion fra en oxidationstilstand på +5 i HNO3 til +4 i NO2.
Sidste artikelHvordan sorterer man væsker efter pH?
Næste artikelHvad er Jeyes Fluid?
 Varme artikler
Varme artikler
-
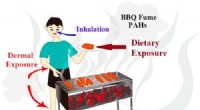 Hud ansvarlig for større eksponering for kræftfremkaldende stoffer i grillrøg end lungerKredit:American Chemical Society Med sommeren på vej, det er kun et spørgsmål om tid, før duften og smagen af grillmad dominerer nabolaget. Men der er en ulempe ved at grille, som bogstaveligt t
Hud ansvarlig for større eksponering for kræftfremkaldende stoffer i grillrøg end lungerKredit:American Chemical Society Med sommeren på vej, det er kun et spørgsmål om tid, før duften og smagen af grillmad dominerer nabolaget. Men der er en ulempe ved at grille, som bogstaveligt t -
 Forskere opdager serendipitalt sjælden klyngeforbindelseMetaloxidklyngerne opnået i denne undersøgelse er positivt (+) ladede i modsætning til konventionelle negativt (-) ladede. Dens overfladeprotoner er meget sure, hvilket er vigtigt i katalyse. Kredit:M
Forskere opdager serendipitalt sjælden klyngeforbindelseMetaloxidklyngerne opnået i denne undersøgelse er positivt (+) ladede i modsætning til konventionelle negativt (-) ladede. Dens overfladeprotoner er meget sure, hvilket er vigtigt i katalyse. Kredit:M -
 Temperatursensor kan hjælpe med at beskytte mRNA-vaccinerNår temperaturen på et hætteglas med simuleret vaccine stiger over -60 C i mere end 2 minutter, et blåt farvestof i et tilstødende rør diffunderer ind i en hvid absorbent, efterlader et irreversibelt
Temperatursensor kan hjælpe med at beskytte mRNA-vaccinerNår temperaturen på et hætteglas med simuleret vaccine stiger over -60 C i mere end 2 minutter, et blåt farvestof i et tilstødende rør diffunderer ind i en hvid absorbent, efterlader et irreversibelt -
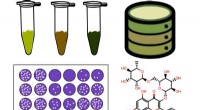 Et stof, der findes i brunkul, kan hjælpe med at bekæmpe viraAntiviral aktivitet af ti humusstofprøver (HS) blev vurderet mod flåtbåren encephalitisvirus reproduktion. For at afsløre mulige aktive komponenter i HS -prøver blev der søgt efter FTICR MS -data i Ch
Et stof, der findes i brunkul, kan hjælpe med at bekæmpe viraAntiviral aktivitet af ti humusstofprøver (HS) blev vurderet mod flåtbåren encephalitisvirus reproduktion. For at afsløre mulige aktive komponenter i HS -prøver blev der søgt efter FTICR MS -data i Ch
- Hvor centrale er kvindelige karakterer i en film?
- Fysikere rapporterer om nanoteknologisk bedrift med proteiner
- At springe sten over på isen giver vanvittige sci-fi-lyde
- Vil fødekæderne bryde, efterhånden som sæsonerne bliver mere uforudsigelige?
- RoboBee drevet af bløde muskler
- Ultrafølsom blydetektor kan forbedre overvågningen af vandkvaliteten betydeligt


