Hvorfor har kovalente stoffer lave smeltepunkter?
I kovalente stoffer bestemmer styrken af de kovalente bindinger smeltepunktet. Jo stærkere de kovalente bindinger er, jo mere energi kræves der for at bryde dem og adskille molekylerne, hvilket resulterer i et højere smeltepunkt. Men da van der Waals-kræfter er relativt svage i kovalente stoffer, er den energi, der kræves for at overvinde disse intermolekylære kræfter og tillade molekylerne at bevæge sig forbi hinanden, forholdsvis lille.
Som et resultat har kovalente stoffer en tendens til at have lavere smeltepunkter sammenlignet med ioniske eller metalliske stoffer. Ioniske og metalliske stoffer har stærkere intermolekylære kræfter, såsom elektrostatiske tiltrækninger mellem henholdsvis ioner eller metalliske bindinger. Disse stærkere intermolekylære kræfter kræver mere energi at overvinde, hvilket fører til højere smeltepunkter.
Et kovalent stofs smeltepunkt afhænger også af molekylvægten og molekylstrukturen. Større molekyler og mere komplekse molekylære strukturer har generelt stærkere van der Waals-kræfter på grund af det øgede overfladeareal for intermolekylære interaktioner. Derfor har de en tendens til at have højere smeltepunkter sammenlignet med mindre molekyler med enklere strukturer.
Sammenfattende har kovalente stoffer lave smeltepunkter, fordi de intermolekylære kræfter, der holder deres molekyler sammen, er relativt svage van der Waals-kræfter. Styrken af de kovalente bindinger i molekylerne, molekylvægten og molekylstrukturen spiller også en rolle i bestemmelsen af et kovalent stofs smeltepunkt.
 Varme artikler
Varme artikler
-
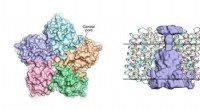 Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb
Forskere afslører strukturen af virale rhodopsinerTil venstre:et billede af OLPVRII -pentameren fra den cytoplasmatiske side. Den centrale pore er kontureret af en rød cirkel. Til højre:set fra siden af pentameren. Den centrale pore er farvet lyseb -
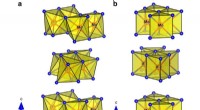 En ny metode til at udvinde brint fra vand mere effektivt for at opfange vedvarende energiKrystalstruktur og {MoTe}6 polyedre, der viser byggestenene i hver polymorf. en monoklinisk 1T′-MoTe2-fase og b hexagonal 2H-MoTe2-fase. Kredit: Naturkommunikation 10.1038/s41467-019-12831-0 En n
En ny metode til at udvinde brint fra vand mere effektivt for at opfange vedvarende energiKrystalstruktur og {MoTe}6 polyedre, der viser byggestenene i hver polymorf. en monoklinisk 1T′-MoTe2-fase og b hexagonal 2H-MoTe2-fase. Kredit: Naturkommunikation 10.1038/s41467-019-12831-0 En n -
 Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa
Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa -
 Forskere udvikler en ny heterostrukturkatalysator til effektiv brintgenerering fra vandspaltningAC Transit brint brændselscelle bus. Kredit:Eric Fischer. Bekymringer om stigende atmosfæriske kuldioxidniveauer og global opvarmning har gjort det til en miljømæssig nødvendighed at erstatte fossi
Forskere udvikler en ny heterostrukturkatalysator til effektiv brintgenerering fra vandspaltningAC Transit brint brændselscelle bus. Kredit:Eric Fischer. Bekymringer om stigende atmosfæriske kuldioxidniveauer og global opvarmning har gjort det til en miljømæssig nødvendighed at erstatte fossi
- Hvorfor træffer håbefulde forbrugere sundere valg end glade?
- Sådan fungerer fyrværkeri
- Hvad er fakta om klatter i et flaskevidenskabeligt eksperiment?
- Hvordan brugen af forskellige former for titaniumoxid påvirker perovskit-solcellens ydeevne
- Undersøgelse kortlægger rødderne til globalt mangrovetab
- "How to Calculate Delta H F


