Sænkes pH-værdien af en vandprøve mere, når lige store mængder CO2 eller SO2 tilføres?
Både $CO_2$ og $SO_2$ reagerer med vand og danner syrer, men $SO_2$ producerer en stærkere syre.
$$CO_2(g) + H_2O(l) ⇌ H_2CO_3(aq)$$
$$H_2CO_3(aq) ⇌ H^+(aq) + HCO_3^-(aq); Ka_1 =4,5\time10^{-7}$$
$$SO_2(g) + H_2O(l) \højrepil H^+(aq) + HSO_3^-(aq)$$
$$HSO_3^-(aq) \højrepil H^+(aq) + SO_3^{-2}(aq); Ka_2 =1,2 \ gange 10^{-2}$$
Den stærkere surhedsgrad af svovlsyre ($H_2SO_3$) sammenlignet med kulsyre ($H_2CO_3$) skyldes den højere stabilitet af sulfationen ($SO_3^{-2}$).
Derfor vil indføring af en lige mængde $SO_2$ i vand resultere i en lavere pH end at indføre en tilsvarende mængde af $CO_2$.
 Varme artikler
Varme artikler
-
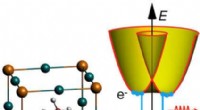 Lyser på rekombinationsmekanismer i solcellematerialerStærk spin-orbit-kobling i halogenidperovskitter inducerer spaltning af båndkanterne, hvilket kan påvirke rekombinationshastigheden. Kredit:X. Zhang og J.-X. Shen Hybride perovskiter er spektakulæ
Lyser på rekombinationsmekanismer i solcellematerialerStærk spin-orbit-kobling i halogenidperovskitter inducerer spaltning af båndkanterne, hvilket kan påvirke rekombinationshastigheden. Kredit:X. Zhang og J.-X. Shen Hybride perovskiter er spektakulæ -
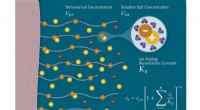 Forskning beskriver, hvordan ioner spiller en nøglerolle i at kontrollere slimhindeoverfladerKredit:KC Jones (Keck Graduate Institute) To nylige artikler fra Keck Graduate Institute (KGI) professor James Sterling og Shenda Baker, President og COO hos Synedgen, beskrive hvordan ioner inter
Forskning beskriver, hvordan ioner spiller en nøglerolle i at kontrollere slimhindeoverfladerKredit:KC Jones (Keck Graduate Institute) To nylige artikler fra Keck Graduate Institute (KGI) professor James Sterling og Shenda Baker, President og COO hos Synedgen, beskrive hvordan ioner inter -
 Nikkel i røntgenlysetForskere fra Argonne og University of California i Santa Barbara har identificeret en anden elementær aktør, der hjælper med at aktivere palladium og samtidig reducere mængden af det ædle metal, der
Nikkel i røntgenlysetForskere fra Argonne og University of California i Santa Barbara har identificeret en anden elementær aktør, der hjælper med at aktivere palladium og samtidig reducere mængden af det ædle metal, der -
 Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø
Appellerende fund tyder på, hvorfor køling dæmper bananaromaerKredit:American Chemical Society Bananer er en af verdens mest populære frugter. Men hvordan de opbevares, før de når dagligvarehylderne, kan påvirke deres smag og lugt negativt. Nu i en undersø
- Klimaændringer og fritidsaktiviteter ved Walden Pond har ændret dets økosystem
- Natriumacetat og vand kemisk ligning?
- Hvorfor San Francisco føltes som et sci-fi-film
- Selvkørende laboratorium fremskynder forskning, syntese af energimaterialer
- Sjælden 8, 000 år gammel børnebegravelse afslører de dødes hemmeligheder
- Forskere udpeger de krybende nanokrystaller bag lithium-ion-batteriets nedbrydning


