Hvad er molariteten af HNO3, hvis 20,0 ml opløsning er nødvendig for nøjagtigt at neutralisere 10,0 en 1,67 M NaOH-opløsning?
$$M_{HNO3} =\frac{M_{NaOH} \times V_{NaOH}}{V_{HNO3}}$$
hvor:
- \(M_{HNO3}\) er molariteten af HNO3-opløsningen
- \(M_{NaOH}\) er molariteten af NaOH-opløsningen (givet som 1,67 M)
- \(V_{NaOH}\) er volumenet af den anvendte NaOH-opløsning (givet som 10,0 ml)
- \(V_{HNO3}\) er volumenet af den anvendte HNO3-opløsning (20,0 mL)
Ved at erstatte de givne værdier får vi:
$$M_{HNO3} =\frac{1,67 \text{ M} \times 10,0 \text{ mL}}{20,0 \text{ mL}} =0,835 \text{ M}$$
Derfor er molariteten af HNO3-opløsningen 0,835 M.
Sidste artikelHvorfor anbefales det ikke at sætte natriummetal på din hånd?
Næste artikelHvordan opstår kogende vand?
 Varme artikler
Varme artikler
-
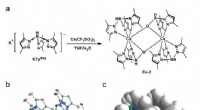 Lys fra sjældne jordarter:Nye muligheder for organiske lysdioderSyntesevej og molekylær struktur af Ce-2 kompleks. Kredit:Science China Press 2,8 eV) gør blå phosphorescerende OLED dårligt stabil. Derfor, de blå lysemitterende materialer, der i øjeblikket anve
Lys fra sjældne jordarter:Nye muligheder for organiske lysdioderSyntesevej og molekylær struktur af Ce-2 kompleks. Kredit:Science China Press 2,8 eV) gør blå phosphorescerende OLED dårligt stabil. Derfor, de blå lysemitterende materialer, der i øjeblikket anve -
 Ferrofluid overfladesimuleringer går mere end huden dybtFerrofluids magnetiske reaktioner kan modelleres til at udvide deres anvendelse inden for en bredere vifte af områder som avanceret elektronik og nanomedicin. Kredit:KAUST Computermodeller simuler
Ferrofluid overfladesimuleringer går mere end huden dybtFerrofluids magnetiske reaktioner kan modelleres til at udvide deres anvendelse inden for en bredere vifte af områder som avanceret elektronik og nanomedicin. Kredit:KAUST Computermodeller simuler -
 Knækker koden for et formskiftende proteinKredit:Pixabay/CC0 Public Domain Et formskiftende immunsystemprotein kaldet XCL1 udviklede sig fra en enkelt-formede forfader for hundreder af millioner af år siden. Nu, forskere ved Medical Colle
Knækker koden for et formskiftende proteinKredit:Pixabay/CC0 Public Domain Et formskiftende immunsystemprotein kaldet XCL1 udviklede sig fra en enkelt-formede forfader for hundreder af millioner af år siden. Nu, forskere ved Medical Colle -
 Flyt over Rover:Der er et nyt snusende kraftcenter i nabolagetElefanten Kelly leder efter mad over øjenhøjde ved hjælp af sin snabel. Kredit:Thomas Spencer, CC-BY Nogle dyr har en superkraft i deres lugtesans. De udforsker, fortolke og forstå deres verden me
Flyt over Rover:Der er et nyt snusende kraftcenter i nabolagetElefanten Kelly leder efter mad over øjenhøjde ved hjælp af sin snabel. Kredit:Thomas Spencer, CC-BY Nogle dyr har en superkraft i deres lugtesans. De udforsker, fortolke og forstå deres verden me
- Hvad er kilderne til CFC'er?
- Snap bønner svære at dyrke i dækafgrøderester
- På University of Texas i Dallas voksende campus, robotter, der leverer måltider, får en splashy d…
- Undersøgelse projekterer, hvordan bjergklimasystemer vil ændre sig med stigende kuldioxid
- Den næste totale solformørkelse er i april:Her er hvad du skal vide, og hvor du kan se det
- Gennem røg og ild, NASA søger efter svar


