Hvad er ammoniakens ka?
Ka-værdien af en base er et mål for dens styrke. Jo stærkere basen er, jo højere er Ka-værdien. For eksempel er Ka-værdien af natriumhydroxid (NaOH) 1,0 x 10^14, hvilket betyder, at det er en meget stærk base, og den dissocierer fuldstændigt i vand.
Ka-værdien af ammoniak er relativt lav, hvilket betyder, at det er en svag base. Det betyder, at det ikke dissocierer fuldstændigt i vand, og der er en betydelig koncentration af udissocierede ammoniakmolekyler i opløsning.
Ka-værdien af en base kan bruges til at beregne pH-værdien af en opløsning af den base. En opløsnings pH er et mål for dens surhedsgrad eller basicitet. Jo lavere pH, desto surere er opløsningen. Jo højere pH, jo mere basisk er opløsningen.
pH-værdien af en opløsning af ammoniak kan beregnes ved hjælp af følgende ligning:
```
pH =14 - log[OH-]
```
hvor [OH-] er koncentrationen af hydroxidioner i opløsningen.
Ka-værdien af ammoniak kan bruges til at beregne koncentrationen af hydroxidioner i en opløsning af ammoniak. Koncentrationen af hydroxidioner kan derefter bruges til at beregne opløsningens pH.
 Varme artikler
Varme artikler
-
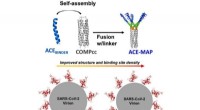 Konstrueret multivalent selvsamlet bindeprotein mod SARS-CoV-2 RBDGrafisk abstrakt. Kredit:Biochemical Engineering Journal (2022). DOI:10.1016/j.bej.2022.108596 Siden den dukkede op i 2019, har COVID-19 krævet over 6 millioner liv og vendt samfundet over hele klo
Konstrueret multivalent selvsamlet bindeprotein mod SARS-CoV-2 RBDGrafisk abstrakt. Kredit:Biochemical Engineering Journal (2022). DOI:10.1016/j.bej.2022.108596 Siden den dukkede op i 2019, har COVID-19 krævet over 6 millioner liv og vendt samfundet over hele klo -
 Nobel Kemi-pristager siger, at den første forhindring var frygt for mørkeDen schweiziske videnskabsmand Jacques Dubochet var en af tre tildelt Nobels kemipris for kryo-elektronmikroskopi, en enklere og bedre metode til billeddannelse af små, frosne molekyler Længe fø
Nobel Kemi-pristager siger, at den første forhindring var frygt for mørkeDen schweiziske videnskabsmand Jacques Dubochet var en af tre tildelt Nobels kemipris for kryo-elektronmikroskopi, en enklere og bedre metode til billeddannelse af små, frosne molekyler Længe fø -
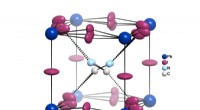 Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio
Perovskite solceller:Mulige aspekter af høj effektivitet afdækketTegningen illustrerer vekselvirkningen af den organiske methylammoniumkation (CH3NH3+) med de omgivende iodidioner. Skiftet af iodidatomerne ud af det fælles plan med bly forårsager brud på inversio -
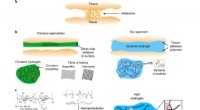 Forskere opdager, at gel reducerer arvæv efter operation hos dyren, Skematisk fremstilling af adhæsionsdannelse mellem to væv. b, Skematisk repræsentation af tidligere tilgange til at forhindre adhæsioner ved hjælp af solide adhæsionsbarrierer til fysisk at adskil
Forskere opdager, at gel reducerer arvæv efter operation hos dyren, Skematisk fremstilling af adhæsionsdannelse mellem to væv. b, Skematisk repræsentation af tidligere tilgange til at forhindre adhæsioner ved hjælp af solide adhæsionsbarrierer til fysisk at adskil
- Der er fundet beviser for overfluiditet i ekstremt kolde 2D -gaser af fermioner
- Forskere udvikler nanometertyk elektromagnetisk afskærmningsfilm ved hjælp af MXene
- To mulige måder at bruge sorte huller som energikilde i en fjern fremtid
- Er siliciumdioxid en forbindelse eller blanding?
- Værktøjer brugt i stenalderen
- opfordrer til lovgivningsmæssige tiltag for at styrke offentliggørelsen af biodiversitet


