Hvordan adskiller en neutraliseringsreaktion sig fra typisk dobbeltforskydningsreaktion?
Syre + Base → Salt + Vand
Når vi blander en opløsning af saltsyre (HCl) og natriumhydroxid (NaOH) i passende koncentrationer sammen i en neutraliseringsreaktion, er reaktionen sådan her:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Som vi kan se, kombineres den positivt ladede hydrogen (H+)-ion i saltsyre med den negativt ladede hydroxid-ion (OH-) i natriumhydroxid og danner et molekyle af vand (H2O). Samtidig går de resterende natrium (Na+) og chlorid (Cl-) ioner sammen og danner en ny forbindelse, natriumchlorid (NaCl), som er et salt.
I sammenligning med en typisk dobbeltforskydningsreaktion, hvor to ioniske forbindelser udveksler deres ioner for at danne nye forbindelser, er den vigtigste kendetegnende faktor i en neutraliseringsreaktion tilstedeværelsen af en syre og en base som reaktanterne. Syren donerer H+ ioner, og basen donerer OH- ioner, som kombineres specifikt for at danne vand som et af produkterne. Dette karakteristiske træk adskiller neutraliseringsreaktionen fra andre dobbeltforskydningsreaktioner.
 Varme artikler
Varme artikler
-
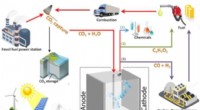 Forskere laver alkohol ud af den blå luftTre forskellige måder, hvorpå elektroreduktion af CO2 potentielt kan lukke kulstofkredsløbet. Kredit:Delft University of Technology Det lyder måske for godt til at være sandt, men TU Delft-ph.d.-s
Forskere laver alkohol ud af den blå luftTre forskellige måder, hvorpå elektroreduktion af CO2 potentielt kan lukke kulstofkredsløbet. Kredit:Delft University of Technology Det lyder måske for godt til at være sandt, men TU Delft-ph.d.-s -
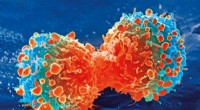 Avanceret kræftlægemiddel krymper og interkalerer DNAKræftcelle under celledeling. Kredit:National Institutes of Health På grund af de skadelige bivirkninger af kemoterapi, og den stigende resistens over for lægemidler, der findes i mange kræftcelle
Avanceret kræftlægemiddel krymper og interkalerer DNAKræftcelle under celledeling. Kredit:National Institutes of Health På grund af de skadelige bivirkninger af kemoterapi, og den stigende resistens over for lægemidler, der findes i mange kræftcelle -
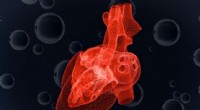 Undersøgelse forudsiger hjertecellers reaktion på svindende iltKandidatstuderende Anthony McDougal har udviklet en model, der forudsiger en enkelt hjertecelles reaktion på svindende iltforsyning. Kredit:MIT News Tid er af afgørende betydning, når man behandle
Undersøgelse forudsiger hjertecellers reaktion på svindende iltKandidatstuderende Anthony McDougal har udviklet en model, der forudsiger en enkelt hjertecelles reaktion på svindende iltforsyning. Kredit:MIT News Tid er af afgørende betydning, når man behandle -
 Ny teknik til bestemmelse af afstand i cellerIn-celleafstandsbestemmelse ved EPR afslører væsentlig strukturel information om biomakromolekyler under native betingelser. For første gang, den pulserede EPR -teknik RIDME (relaxation induced dipola
Ny teknik til bestemmelse af afstand i cellerIn-celleafstandsbestemmelse ved EPR afslører væsentlig strukturel information om biomakromolekyler under native betingelser. For første gang, den pulserede EPR -teknik RIDME (relaxation induced dipola
- Video:De lange arme og korte ben krige i palæoantropologi
- Fakta om og årsager til vulkaner
- Anti-hacker-teamet udvikler datadelingsskema til skylagring
- Nyt batteri tapper kuldioxid op
- Undersøgelse introducerer tabsfri stofbølgepolaritoner i et optisk gittersystem
- Hvad er resultatet, når ilt binder til brint?


