Hvad er hydroxidionkoncentrationen af en opløsning, hvis pH er 12,40?
pH =-log[H+]
og
[H+][OH-] =Kw
hvor Kw er ionproduktkonstanten for vand (Kw =1,0 x 10^-14 ved 25°C).
Først beregner vi hydrogenionkoncentrationen ([H+]) ved hjælp af den givne pH:
[H+] =10^(-pH)
[H+] =10^(-12,40)
[H+] =3,98 x 10^-13 M
Dernæst bruger vi forholdet [H+][OH-] =Kw til at beregne [OH-]:
[OH-] =Kw/[H+]
[OH-] =(1,0 x 10^-14)/(3,98 x 10^-13)
[OH-] =2,51 x 10^-2 M
Derfor er opløsningens hydroxidionkoncentration 2,51 x 10^-2 M.
Sidste artikelHvor har elektroner tendens til at sætte sig?
Næste artikelHvad er oxidationstallet for O i formlen KNO3?
 Varme artikler
Varme artikler
-
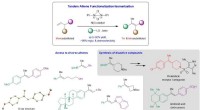 Stereoselektiv alkensyntese med ikke-ædel nikkelkatalyseSkematisk, der viser udviklingen af et nyt Ni-katalyseret system, der konverterer billige og let tilgængelige monosubstituerede olefiner til højværdi tri- og tetrasubstituerede analoger, og dets anv
Stereoselektiv alkensyntese med ikke-ædel nikkelkatalyseSkematisk, der viser udviklingen af et nyt Ni-katalyseret system, der konverterer billige og let tilgængelige monosubstituerede olefiner til højværdi tri- og tetrasubstituerede analoger, og dets anv -
 Afsætning af jernarter inde i ZSM-5 for at oxidere cyclohexan til cyclohexanonKredit:Unsplash/CC0 Public Domain Den direkte katalytiske oxidation af alkaner har høj atomøkonomi og anvendelsesværdi til dannelse af tilsvarende kemiske organiske produkter, såsom alkoholer, ald
Afsætning af jernarter inde i ZSM-5 for at oxidere cyclohexan til cyclohexanonKredit:Unsplash/CC0 Public Domain Den direkte katalytiske oxidation af alkaner har høj atomøkonomi og anvendelsesværdi til dannelse af tilsvarende kemiske organiske produkter, såsom alkoholer, ald -
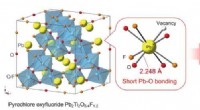 Forskere rapporterer om ny oxyfluoridforbindelse til fotokatalyseIndsatsen viser et billede af Pb 2 Ti 2 O 5 . 4 F 1 . 2 , vist at være i stand til at absorbere synligt lys med en bølgelængde på omkring 500 nm. Denne evne menes at skyldes bindingsstrukt
Forskere rapporterer om ny oxyfluoridforbindelse til fotokatalyseIndsatsen viser et billede af Pb 2 Ti 2 O 5 . 4 F 1 . 2 , vist at være i stand til at absorbere synligt lys med en bølgelængde på omkring 500 nm. Denne evne menes at skyldes bindingsstrukt -
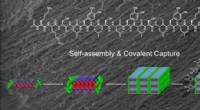 Kemikere udvikler hydrogelstrenge ved hjælp af forbindelse fundet i havdyrRice University kemikere brugte klæbeevnen af en forbindelse fundet i muslinger og forskydningskraft til at hjælpe en nanoskala, multidomæne peptid, set øverst, samles selv til et fiberbundt, der ka
Kemikere udvikler hydrogelstrenge ved hjælp af forbindelse fundet i havdyrRice University kemikere brugte klæbeevnen af en forbindelse fundet i muslinger og forskydningskraft til at hjælpe en nanoskala, multidomæne peptid, set øverst, samles selv til et fiberbundt, der ka
- ESA identificerer efterspørgsel efter satellitter omkring månen
- I 50 år har massefængsling skadet amerikanske familier. Sådan ændres det
- Kulstof nanorør dobbelt så stærke som engang troede
- Forskere lancerer søgen efter at udvikle kvantesensorer til at sondere kvantematerialer
- Overdimensionerede vindmøller genererer ren energi - og overraskende fysik
- Hvad er forskellen mellem monomerer og isomerer?


