Hvad er effekten af HCl på forbrændt og uforbrændt Mg-strimmel?
Brændt Mg Strip:
Når en brændt magnesiumstrimmel omsættes med saltsyre (HCl), sker følgende reaktion:
```
MgO(s) + 2HCl(aq) → MgCl2(aq) + H2O(l)
```
I denne reaktion reagerer det brændte magnesiumoxid (MgO) med saltsyren og danner magnesiumchlorid (MgCl2) og vand (H2O). Reaktionen frembringer et hvidt bundfald af magnesiumhydroxid, som er uopløseligt i vand. Reaktionen er eksoterm, hvilket betyder, at den frigiver varme.
Ubrændt Mg Strip:
Når en uforbrændt magnesiumstrimmel omsættes med saltsyre (HCl), sker følgende reaktion:
```
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
```
I denne reaktion reagerer det uforbrændte magnesiummetal (Mg) med saltsyren og danner magnesiumchlorid (MgCl2) og hydrogengas (H2). Reaktionen frembringer en farveløs opløsning af magnesiumchlorid og bobler af hydrogengas. Reaktionen er også eksoterm og frigiver varme.
Sammenligning af reaktioner:
Reaktionerne mellem brændte og uforbrændte magnesiumstrimler med HCl er ens, idet de både producerer magnesiumchlorid og frigiver varme. Der er dog nogle vigtige forskelle mellem de to reaktioner:
* Reaktionen mellem forbrændt Mg og HCl giver et hvidt bundfald af magnesiumhydroxid, mens reaktionen mellem uforbrændt Mg og HCl ikke gør det.
* Reaktionen mellem uforbrændt Mg og HCl producerer bobler af hydrogengas, mens reaktionen mellem forbrændt Mg og HCl ikke gør det.
Disse forskelle skyldes de forskellige sammensætninger af udgangsmaterialerne. Brændt Mg indeholder magnesiumoxid, mens uforbrændt Mg indeholder magnesiummetal. Magnesiumoxidet i forbrændt Mg reagerer med HCl og danner magnesiumhydroxid, mens magnesiummetallet i uforbrændt Mg reagerer med HCl og danner brintgas.
 Varme artikler
Varme artikler
-
 Forskere afslører kunsten at trykke ekstremt hårdt stål fejlfritMartensit stålpulver brugt til 3D-print. Indsat viser en zoomet visning af stålpulveret. Kredit:Raiyan Seede/Texas A&M University College of Engineering I årtusinder, metallurger har omhyggeligt j
Forskere afslører kunsten at trykke ekstremt hårdt stål fejlfritMartensit stålpulver brugt til 3D-print. Indsat viser en zoomet visning af stålpulveret. Kredit:Raiyan Seede/Texas A&M University College of Engineering I årtusinder, metallurger har omhyggeligt j -
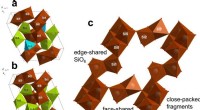 Silica paradoks:Forskere opdager tilsyneladende umuligt materialeHavet), (b) er rumlige krystalgitter af coesit, (c) viser uindpakket gitter med tydeligt synlige fragmenter af SiO6, paradoksalt nok forbundet af ansigterne. Kredit:NUST MISIS Et internationalt te
Silica paradoks:Forskere opdager tilsyneladende umuligt materialeHavet), (b) er rumlige krystalgitter af coesit, (c) viser uindpakket gitter med tydeligt synlige fragmenter af SiO6, paradoksalt nok forbundet af ansigterne. Kredit:NUST MISIS Et internationalt te -
 Forskere sætter AI i gang med at lave kemiforudsigelserKredit:Caltech Efterhånden som kemien er blevet mere avanceret og de kemiske reaktioner mere komplekse, det er ikke længere altid praktisk for forskere at sætte sig ved en laboratoriebænk og begyn
Forskere sætter AI i gang med at lave kemiforudsigelserKredit:Caltech Efterhånden som kemien er blevet mere avanceret og de kemiske reaktioner mere komplekse, det er ikke længere altid praktisk for forskere at sætte sig ved en laboratoriebænk og begyn -
 Tilføjelse af kobber styrker 3-D-printet titanium3D-printede titanium-kobber stænger med titanium pulver og kobber pulver. Kredit:RMIT University Vellykkede forsøg med titanium-kobber-legeringer til 3-D-print kan kickstarte en ny serie af højtyd
Tilføjelse af kobber styrker 3-D-printet titanium3D-printede titanium-kobber stænger med titanium pulver og kobber pulver. Kredit:RMIT University Vellykkede forsøg med titanium-kobber-legeringer til 3-D-print kan kickstarte en ny serie af højtyd
- Er metan opløseligt i organisk opløsningsmiddel?
- Forskning ved Baikal-søen - til beskyttelse af et unikt økosystem
- Hvorfor har aerob metabolisme en fordel i forhold til anaerob i levende ting?
- NASA finder nydannet tropisk stormlan over åbent vand
- Hvad er produktet af følgende reaktion HNO3 plus KOH à?
- Overgang til en ren økonomi kan spare Australien for hundredvis af milliarder, rapport finder


