Hvad er massen af HCl, der kræves for at reagere fuldstændigt med 5,2 gram Mg?
$$Mg(s) + 2HCl(aq) → MgCl_2(aq) + H_2(g)$$
Nu skal vi bestemme antallet af mol Mg i 5,2 gram. For at gøre dette deler vi massen af Mg med dens molære masse. Den molære masse af Mg er 24,31 g/mol.
$$5,2 \text{ g Mg} \times \frac{1 \text{ mol Mg}}{24,31 \text{ g Mg}} =0,214 \text{ mol Mg}$$
Ifølge den afbalancerede kemiske ligning reagerer 1 mol Mg med 2 mol HCl. Derfor har vi brug for 0,428 mol HCl for fuldstændigt at reagere med 5,2 gram Mg.
Til sidst skal vi bestemme massen af HCl, der svarer til 0,428 mol. For at gøre dette multiplicerer vi antallet af mol med den molære masse af HCl. Den molære masse af HCl er 36,46 g/mol.
$$0,428 \text{ mol HCl} \times 36,46 \text{ g HCl/mol} =15,6 \text{ g HCl}$$
Derfor er massen af HCl, der ville være påkrævet for at reagere fuldstændigt med 5,2 gram Mg, 15,6 gram.
 Varme artikler
Varme artikler
-
 Fotoinitiatorer til tandfyldninger, kontaktlinser og tandproteserForskere ved Graz University of Technology har udviklet en ny, væsentligt billigere produktionsmetode for germanium-baserede fotoinitiatorer. Dette åbner op for yderligere anvendelsesområder ud over d
Fotoinitiatorer til tandfyldninger, kontaktlinser og tandproteserForskere ved Graz University of Technology har udviklet en ny, væsentligt billigere produktionsmetode for germanium-baserede fotoinitiatorer. Dette åbner op for yderligere anvendelsesområder ud over d -
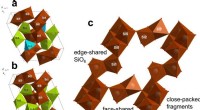 Silica paradoks:Forskere opdager tilsyneladende umuligt materialeHavet), (b) er rumlige krystalgitter af coesit, (c) viser uindpakket gitter med tydeligt synlige fragmenter af SiO6, paradoksalt nok forbundet af ansigterne. Kredit:NUST MISIS Et internationalt te
Silica paradoks:Forskere opdager tilsyneladende umuligt materialeHavet), (b) er rumlige krystalgitter af coesit, (c) viser uindpakket gitter med tydeligt synlige fragmenter af SiO6, paradoksalt nok forbundet af ansigterne. Kredit:NUST MISIS Et internationalt te -
 Biokemikere afslører indsigt i ekstraordinær regenerativ evneIana Kim, første forfatter til den nye undersøgelse, i et laboratorium for forskningsgruppen Gene Regulation by Non-coding RNA ved University of Bayreuth. Kredit:Christian Wißler Planarer er flado
Biokemikere afslører indsigt i ekstraordinær regenerativ evneIana Kim, første forfatter til den nye undersøgelse, i et laboratorium for forskningsgruppen Gene Regulation by Non-coding RNA ved University of Bayreuth. Kredit:Christian Wißler Planarer er flado -
 Forskning i ren luft omdanner giftig luftforurening til industrikemikalieMFM-520. Kredit:University of Manchester Et giftigt forurenende stof produceret ved afbrænding af fossile brændstoffer kan opsamles fra udstødningsgasstrømmen og omdannes til nyttige industrielle
Forskning i ren luft omdanner giftig luftforurening til industrikemikalieMFM-520. Kredit:University of Manchester Et giftigt forurenende stof produceret ved afbrænding af fossile brændstoffer kan opsamles fra udstødningsgasstrømmen og omdannes til nyttige industrielle
- Sprøjtefri zoner adskiller franske landmænd fra ængstelige naboer
- Havplanter i sollyset
- Ifølge undersøgelse, penge køber ikke lykke – eller ansporer til generøsitet
- GeoSEA -array registrerer glidning af Mount Etnas sydøstlige flanke
- Sådan fungerer automatiske solpanelrengøringssystemer
- Heads Up:Massiv mørk materie -orkan, der passerer jorden


